
16 Dic Aporte de Combustible en Función del Trabajo Requerido: Marco Teórico para la Periodización de Carbohidratos y para la Hipótesis del Umbral de Glucógeno
Samuel G. Impey1, Mark A. Hearris 1, Kelly M. Hammond1, Jonathan D. Bartlett2, Julien Luis1, Graeme L. Close1, James P. Morton 1
1Research Institute for Sport and Exercise Sciences, Liverpool John Moores University, Tom Reilly Building, Byrom St Campus, Liverpool L3 3AF, UK.
2Institute of Sport, Exercise and Active Living (ISEAL), Victoria University, Footscray Park, Ballarat Road, Melbourne, VIC 8001, Australia.
Resumen: No quedan dudas de que el entrenamiento con una baja disponibilidad de carbohidratos (CHO) para mejorar las adaptaciones metabólicas inducidas por el entrenamiento de resistencia en el músculo esquelético (es decir, el paradigma de “entrenar bajo, competir alto”) es un tema candente dentro de la nutrición deportiva. Los estudios de “entrenar bajo” consisten en entrenamiento periódico (p. Ej., 30-50% de las sesiones de entrenamiento) con una disponibilidad reducida de CHO, y los modelos de entrenar bajo incluyen entrenamiento dos veces al día, entrenamiento en ayunas, restricción de CHO post-ejercicio y ‘dormir poco, entrenar bajo’. Cuando se compara con la alta disponibilidad de CHO, los datos sugieren que el aumento en la señalización celular (73% de 11 estudios), en la expresión genética (75% de 12 estudios) y los incrementos inducidos por el entrenamiento en la actividad de las enzimas oxidativas/contenido de proteínas (78% de 9 estudios) asociados con “entrenamiento bajo” son especialmente evidentes cuando las sesiones de entrenamiento se inician dentro de un intervalo específico de concentraciones de glucógeno muscular. Sin embargo, tales adaptaciones musculares no siempre se traducen en un mejor rendimiento físico (por ejemplo, 37 y 63% de los 11 estudios observaron mejoras o ningún cambio, respectivamente).
A continuación, presentamos nuestro fundamento para la hipótesis del umbral de glucógeno, una ventana de concentraciones de glucógeno muscular que permite simultáneamente completar las cargas de trabajo de entrenamiento requeridas y activar la maquinaria molecular que regula las adaptaciones al entrenamiento. También presentamos el paradigma del “aporte de combustible en función del trabajo requerido” (representativo de un conjunto de modelos de entrenar bajo) en el cual la disponibilidad de CHO se ajusta en función de las demandas de las sesiones de entrenamiento posteriores. Con el fin de implementar estratégicamente las sesiones, nuestro desafío actualmente es cuantificar el costo de glucógeno de las sesiones de entrenamiento habituales (para informar el alcance de cualquier umbral potencial) y garantizar que no se vea afectada la intensidad de entrenamiento absoluta, al tiempo que también se crea un medio ambiente metabólico propicio para facilitar el fenotipo de resistencia.
Puntos clave: Completar periódicamente sesiones de entrenamiento de resistencia. (por ejemplo, 30-50% de las sesiones de entrenamiento) con una disponibilidad de carbohidratos (CHO) reducida favorece la activación de las vías de señalización celular aguda (73% de 11 estudios), promueve las adaptaciones oxidativas inducidas por el entrenamiento en el músculo esquelético (78% de 9 estudios) y, en algunos casos, mejora el rendimiento físico (aunque solo el 37% de los 11 estudios observaron mejoras en el rendimiento).
Proponemos la existencia de un umbral de glucógeno muscular donde la superación de un nivel absoluto crítico
de agotamiento de glucógeno durante el entrenamiento es especialmente potente para modular la activación de adaptaciones agudas y crónicas del músculo esquelético asociadas con el “entrenar bajo”.
Las futuras investigaciones deberían intentar cuantificar el costo de glucógeno y de CHO de las sesiones de entrenamiento típicas de los atletas de resistencia para aumentar nuestra comprensión sobre las condiciones de ejercicio que pueden provocar el umbral de glucógeno propuesto, y de esta manera describir la aplicación práctica del paradigma “combustible para el trabajo requerido”.
Introducción
El principio de asegurar una adecuada disponibilidad de carbohidratos (CHO) antes, durante y después del entrenamiento y de las competencias es ampliamente reconocido como la prioridad nutricional fundamental para las poblaciones de deportistas. De hecho, la base de las recomendaciones actuales sobre nutrición deportiva [1] fueron desarrolladas por investigadores escandinavos a finales de la década de 1960 con la introducción de la técnica de biopsia muscular [2-5] y del modelo clásico de “supercompensación” de carga de CHO. En otro estudio histórico en 1981, Sherman y sus colegas [6] observaron magnitudes similares de supercompensación de glucógeno con un protocolo menos severo (es decir, sin ejercicio exhaustivo y sin fase de restricción de CHO), en el cual luego de varios días ejercicios de puesta a punto combinados con una moderada ingesta de CHO (por ejemplo, 5 g kg -1 de masa corporal) se planeaban 3 días de una elevada ingesta de CHO (8 g kg -1 de masa corporal). Aunque estos datos tienen aplicación práctica desde una perspectiva pre competencia, uno de los componentes más pasados por alto de este estudio es que no se observaron diferencias en el rendimiento de una carrera de media maratón (realizada al aire libre en una pista de 220 m) entre las pruebas, a pesar de que presentaban diferencias en el nivel de glucógeno muscular pre-ejercicio. Los autores hacen referencia a este resultado cuando plantean la discusión de sus datos:
”Los tiempos de rendimiento indican que la carga de carbohidratos no provocó ningún beneficio para el rendimiento durante la carrera de 20,9 km. De hecho, los tiempos de rendimiento fueron en realidad más lentos en las pruebas con niveles más altos de glucógeno muscular. Esto sugiere que cualquier cosa que se encuentre por encima de un nivel mínimo de glucógeno muscular es innecesaria para los rendimientos de una determinada intensidad y duración. Pero lo más importante, la pregunta práctica no sería ¿cuánto puedo supercompensar, sino más bien, ¿mi dieta contiene suficientes carbohidratos para mantener una adecuada reserva de glucógeno muscular en el día a día para el entrenamiento y las carreras? ” (p. 117).
Además del rendimiento competitivo, el mismo autor principal posteriormente cuestionó el concepto de que una ingesta diaria de CHO insuficiente en días consecutivos de entrenamiento reduce la disponibilidad de glucógeno muscular hasta un nivel que perjudica la capacidad de realizar entrenamiento [7, 8]. Si bien estos efectos dependen indudablemente de las cargas de trabajo de entrenamiento prescritas, casi 30 años después, la interpretación y los aportes anteriores se vuelven más relevantes que nunca. De hecho, actualmente con la incorporación de las técnicas de biología molecular al deporte y a las ciencias del ejercicio, nos encontramos en la era de las “interacciones entre nutrientes y genes” donde la modulación nutricional de las adaptaciones al entrenamiento de resistencia es un área de investigación contemporánea. A partir de que el trabajo seminal de Hansen et al. [9] sugirió que algunas adaptaciones a la actividad física pueden requerir un ‘ciclo’ de reservas de glucógeno muscular, el papel de la disponibilidad de glucógeno como regulador del entrenamiento ha cobrado cada vez más popularidad en el ámbito deportivo [10]. Este trabajo se ha centrado en gran medida en la eficacia del paradigma periódico “entrenar bajo (inteligente), competir alto” por el cual ciertas sesiones de entrenamiento son realizadas deliberadamente con una baja disponibilidad de CHO para activar las vías moleculares que regulan la adaptación del músculo esquelético (Figura 1). Por el contrario, se recomienda que tanto el entrenamiento como las competencias importantes siempre sean realizados con alta disponibilidad de CHO para promover el rendimiento y la recuperación [11, 12]. No obstante, en la actualidad, no se conoce cuál sería el enfoque óptimo para aplicar prácticamente los periodos de “entrenamiento bajo” (actualmente conocido como periodización de CHO) en un programa de entrenamiento deportivo.
En consecuencia, el objetivo de este artículo es presentar una visión contemporánea de las estrategias de periodización de CHO en el entrenamiento desde una perspectiva teórica y práctica. Comenzaremos por esbozar los efectos de diferentes paradigmas de entrenar bajo sobre la modulación de las vías de señalización celular, las adaptaciones al entrenamiento y el rendimiento físico. Luego presentaremos nuestra justificación de la ‘hipótesis del umbral de glucógeno’, una ventana de concentración absoluta de glucógeno muscular con la cual
deberían comenzar las sesiones de entrenamiento para proporcionar un medio metabólico propicio para modular la señalización celular. Finalizaremos presentando un modelo práctico de periodización de CHO según el principio de “aporte de combustible en función el trabajo requerido”. A diferencia de los períodos de restricción crónica de CHO, este modelo sugiere que la disponibilidad de CHO debe regularse día a día y comida por comida en función de la intensidad, duración y metas específicas de entrenamiento. Con esto en mente, definimos la disponibilidad de CHO como la suma de los CHO endógenos (es decir, glucógeno muscular y hepático) y CHO exógenos (es decir, CHO consumido antes y/o durante el ejercicio) que está disponible para mantener la intensidad y duración del entrenamiento. Según esta definición, es posible tener una disponibilidad insuficiente de CHO (incluso si el ejercicio se inicia con reservas de glucógeno muscular altas previas al ejercicio) si se consume una dosis inadecuada de CHO durante el ejercicio para mantener la carga de trabajo deseada [13]. Alternativamente, es posible comenzar el ejercicio con un contenido de glucógeno muscular reducido, pero se considerará que se cuenta con una adecuada disponibilidad de CHO si los CHO exógenos consumido durante el ejercicio permiten que se alcance la intensidad y la duración del entrenamiento deseadas [14].
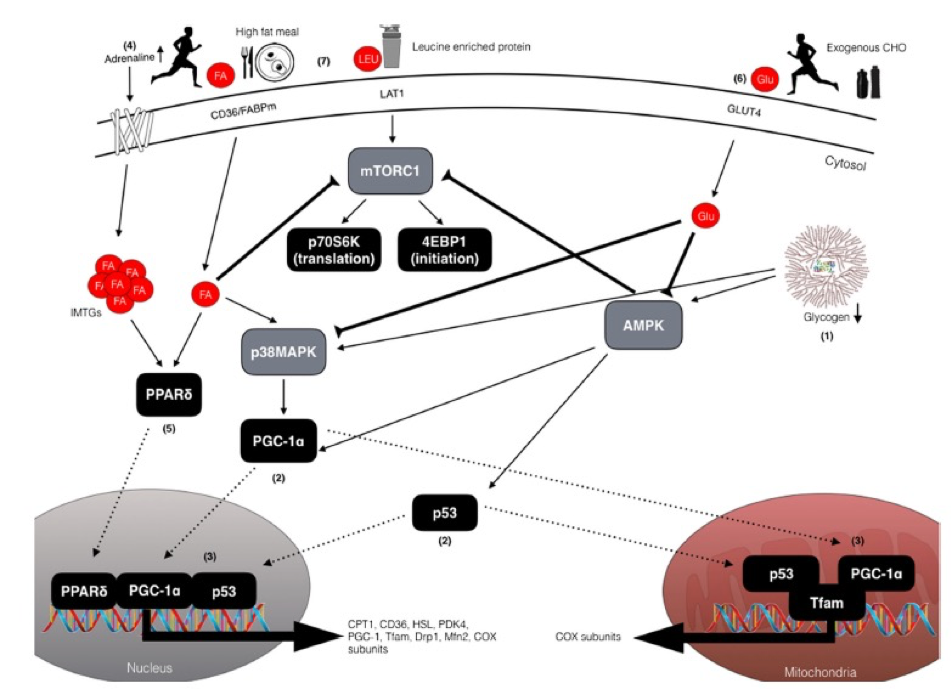
Figura 1. Descripción esquemática de las potenciales vías de señalización celular sensibles al ejercicio y a los nutrientes que regulan la mejora en las adaptaciones mitocondriales asociadas al entrenamiento con baja disponibilidad de CHO. (1) El glucógeno muscular reducido mejora la fosforilación tanto de AMPK como de p38MAPK lo que resulta en (2) activación y translocación de PGC-1α y p53 hacia las mitocondrias y hacia el núcleo. (3) Al entrar en el núcleo, PGC-1 α coactiva factores de transcripción adicionales (es decir, NRF1/2) para aumentar la expresión de subunidades COX y Tfam, y además para autorregular su propia expresión. En las mitocondrias, PGC-1 α coactiva a Tfam para coordinar la regulación del ADN mitocondrial e induce la expresión de proteínas mitocondriales clave de la cadena de transporte de electrones, por ejemplo, subunidades COX. Al igual que PGC1α, p53 también es translocado a las mitocondrias para modular la actividad de Tfam y la expresión del DNA mitocondrial, y al núcleo donde aumenta la expresión de proteínas involucradas en la fisión y fusión mitocondrial (DRP-1 y MFN-2) y proteínas de la cadena de transporte de electrones (4). El ejercicio en condiciones de disponibilidad reducida de CHO aumenta la lipólisis en el tejido adiposo e intramuscular a través del aumento de la concentración de adrenalina circulante (5). El aumento resultante de ácidos grasos libres (FFA) activa al factor de transcripción nuclear, PPARδ, para aumentar la expresión de proteínas implicadas en el metabolismo de los lípidos, tales como CPT1, PDK4, CD36 y HSL. (6) Sin embargo, consumir alimentos ricos en CHO antes del ejercicio y/o CHO durante el ejercicio puede regular a la baja (inhibir) la lipólisis (anulando así la señalización mediada por los FFA), además de reducir la actividad de AMPK y de p38MAPK, lo que tiene implicaciones negativas para reguladores corriente abajo (7). La alimentación rica en grasas también puede modular la señalización de PPARδ y regular positivamente genes con funciones reguladoras en el metabolismo de los lípidos (y regular a la baja el metabolismo de CHO), aunque las dietas altas en grasas también pueden reducir la síntesis de proteínas musculares a través la alteración de la señalización mTOR-p70S6K, a pesar de haber consumido una alimentación con proteínas ricas en leucina. Factor de iniciación de la traducción eucariota 4EBP1, AMPK = Proteína quinasa activada por AMP, CHO= carbohidratos, grupo de CD36 de diferenciación 36, COX = Citocromo c oxidasa, CPT1 =Carnitina palmitoiltransferasa 1, Drp1= Proteína 1 relacionada con la dinamina, FA= Acido graso, FABP= Proteína de unión a ácidos grasos, GLU= Glucosa, GLUT4= Transportador de glucosa tipo 4, HSL= Lipasa sensible a hormonas, IMTG= Triglicéridos intramusculares, LAT1=Transportador de aminoácidos neutros grandes, LEU= Leucina, Mfn2= Mitofusion-2, mTORC1= Complejo blanco de rapamicina 1 de mamíferos, p38MAPK= Proteína quinasa activada por mitógenos p38, p53= Proteína tumoral 53, p70S6K= Proteína quinasa ribosómica S6, PDK4= Piruvato deshidrogenasa quinasa 4, PGC-1α= Proteína 1α coactivadora del receptor activado por el proliferador de peroxisomas; PPARd= Receptor activado por proliferador de peroxisoma, Tfam= Factor de transcripción mitocondrial A.
La Restricción de Carbohidratos (CHO) Mejora la Señalización y Expresión Génica de las Células y Modula los Componentes de las Adaptaciones al Entrenamiento y del Rendimiento Físico
Los investigadores han utilizado una variedad de intervenciones de entrenamiento bajo agudo y crónico para investigar la eficacia de la restricción de CHO y de la periodización sobre las adaptaciones al entrenamiento y el rendimiento físico. Una descripción general de los modelos de entrenamiento bajo se discuten a continuación y los detalles de los experimentos de los estudios fundamentales se resumen en la Tabla 1. Además, los resultados claves de dichos estudios también se categorizaron sobre la base de los parámetros de medición de señalización celular, expresión génica, cambios enzimáticos y resultados de rendimiento, en función de si se obserbaban cambios positivos, negativos o no se observen cambios (Tabla 2). A pesar de la evidencia que apoya adaptaciones mejoradas del músculo esquelético con la restricción de CHO, cabe señalar que tales adaptaciones no siempre se traducen en un mejor rendimiento del ejercicio.
Entrenamiento Dos Veces al Día
Sobre la base de que la baja disponibilidad de glucógeno muscular pre [15] y post ejercicio [16] aumenta la expresión de genes que regulan la utilización de sustratos y la biogénesis mitocondrial, los estudios de entrenamiento iniciales adoptaron un diseño de investigación de “entrenar dos veces por día, día por medio versus entrenar una vez al día. En este enfoque, los sujetos realizaban una sesión de entrenamiento por la mañana para reducir el glucógeno muscular y luego varias horas de reducción de ingesta de CHO para que la segunda sesión de entrenamiento del día se inicie con un contenido de glucógeno muscular reducido.
Por medio de este modelo, 3 a 10 semanas de “entrenar bajo” aumentan la actividad de las enzimas oxidativas [9, 17-19], la utilización de lípidos tanto en el cuerpo entero [17, 19] como dentro de los músculos [19] y mejoran la capacidad de ejercicio [9] y el rendimiento [20]. Es difícil determinar si la mejor respuesta al entrenamiento está mediada por la regulación positiva de las respuestas transcripcionales inducidas por la restricción de CHO en la recuperación de la sesión de ejercicios matutina y/o por las mejores respuestas de señalización celular [21- 24] asociadas con el hecho de haber comenzado la sesión de entrenamiento de la tarde con un nivel de glucógeno muscular reducido. Además de la baja disponibilidad de glucógeno, también podrían existir efectos compuestos de juntar sesiones de entrenamiento en tiempos muy próximos donde la alteración del entorno mecánico, metabólico y hormonal también podrían modular una mejor respuesta al entrenamiento. A pesar de una posible reducción en la intensidad absoluta del entrenamiento en la sesión de la tarde [17], el modelo de entrenamiento dos veces al día proporciona un marco práctico donde se incrementa el tiempo total acumulado con un contenido de glucógeno muscular reducido. Dependiendo de la longitud del intervalo entre la primera y la segunda sesión (es decir, recuperar bajo) y la duración real de la segunda sesión de entrenamiento (es decir, entrenar bajo), el período acumulado de nivel de glucógeno bajo podría variar de 3 a 8 h.
Entrenamiento en Ayunas
Hacer ejercicio en ayunas representa un modelo más simple de ‘entrenar bajo’ dado que el desayuno se consume después de una sesión de entrenamiento matutina. En este modelo, el glucógeno muscular pre ejercicio no es diferente entre las condiciones de ayuno o alimentados, pero el glucógeno hepático y la glucosa circulante son más altos en la condición donde los sujetos han consumido alimentos. En contraste, en condiciones de ayuno se produce un aumento de la disponibilidad de ácidos grasos libres (FFA) y oxidación de lípidos ocurren en condiciones de ayuno cuando el ejercicio se equipara en intensidad, duración y trabajo realizado [25]. Dependiendo del momento en que se consumen los CHO en relación con el comienzo del ejercicio (por ejemplo, [>60 min antes del ejercicio versus <10 min antes y/o durante ejercicio), tales diferencias en la disponibilidad de FFA pueden manifestarse desde el comienzo del ejercicio [25] o no presentarse hasta después 30-40 min de ejercicio, respectivamente [26]. Hacer ejercicio en ayunas aumenta la actividad de la proteína quinasa activada por AMP (AMPK) [27] y la expresión génica posterior al ejercicio [28, 29], mientras que varias semanas de entrenamiento en ayunas aumentan la actividad de las enzimas oxidativas [30], el contenido de proteínas transportadoras de lípidos [31] y las reservas de glucógeno en reposo [32]. Sin embargo, es importante resaltar que tales adaptaciones probablemente están reguladas a través de la restricción de CHO y no por verdaderas condiciones de ayuno. En efecto, consumir aproximadamente 20 g de proteína de suero antes y durante las sesiones de entrenamiento con restricción de CHO todavía permite la movilización de FFA [33] y la activación del eje de señalización de AMPK [34], y además mejora el balance proteico neto muscular [35].
Dormir Bajo, Entrenar Bajo
En el modelo ‘dormir bajo, entrenar bajo’, los participantes realizan una sesión de entrenamiento vespertino, restringen los CHO durante la recuperación nocturna y luego realizan una sesión de entrenamiento en ayunas la mañana siguiente. El tiempo total acumulado con el contenido de glucógeno muscular reducido podría extenderse a 12-14 h dependiendo del momento y la duración de las sesiones de entrenamiento y del periodo de sueño. Modelos agudos de “dormir bajo, entrenar bajo ‘(donde comienza el ejercicio matutino con un contenido de glucógeno <200 mmol/kg peso seco) aumentan la activación de AMPK, de la proteína quinasa activada por mitógenos p38 (p38) y la señalización de la proteína tumoral p53 (p53) [36- 38], aunque las respuestas se atenúan si los ciclistas entrenados completan una sesión matutina en estado estacionario (lo que sugiere que tanto la intensidad y el estado de entrenamiento son importantes) donde el contenido de glucógeno antes y después del ejercicio es de 350 y 250 mmol/kg peso seco, respectivamente [39]. Usando un modelo de sueño bajo similar al utilizado por Lane y colegas [39], Marquet et al. [40, 41] observaron en triatletas y ciclistas de élite que entre 1 y 3 semanas de entrenamiento con sueño bajo mejoran la eficiencia de ciclismo (3,1%), el rendimiento en pruebas contrarreloj de ciclismo de 20 km (3,2%) y el rendimiento en carreras de 10 km (2,9%) en comparación con lo que ocurre con los enfoques tradicionales de entrenamiento con alto contenido de glucógeno. En la actualidad, no se conoce con detalle la magnitud de la restricción de CHO necesaria para provocar las condiciones consideradas como representativa de ‘dormir bajo’. Sin embargo, es importante mencionar que los estudios que han observado efectos beneficiosos sobre la señalización celular [38] y las adaptaciones de rendimiento [40, 41] implementaron una restricción completa de CHO después de la sesión de entrenamiento nocturna y después de que los sujetos consumieran una comida o bebida que contenía solo proteínas. No obstante, al igual que otros modelos de entrenar bajo, el paradigma de sueño bajo está sujeto a limitaciones obvias de la falta de un diseño con control con placebo u doble ciego. Tales limitaciones son particularmente relevantes cuando se han observado mejoras de rendimiento con solo tres sesiones de “dormir bajo, entrenar bajo” [41].
| Referencia | Sujetos | Duración
|
Protocolo de ejercicio y nivel de glucógeno (mmol/kg de peso seco) | Adaptaciones en el musculo esquelético | Resultados sobre rendimiento físico |
| Modelo dos veces por día | |||||
| Hansen et al [9] | 7 varones desentrenados
|
10 semanas
5 días x semana
|
Ejercicios para el músculo extensor de la rodilla. Una pierna entrenó el 50% de las sesiones con bajo glucógeno (BAJO), mientras que la otra pierna entrenó todas las sesiones con un alto nivel de glucógeno (ALTO).
Nivel de Glucógeno en la segunda sesión: Condición BAJO: pre: 200 mmol/kg peso seco y post-100 mmol/kg de peso seco, respectivamente. |
Mayor incremento en la actividad de CS en la condición BAJO
Aumento en la actividad β-HAD solo en la condición BAJO |
Mejor TTE en el ejercicio para el extensor de la rodilla |
| Yeo et al. [17]
|
14 varones entrenados ciclistas/ triatletas
|
3 semanas
4 x semana
|
Ejercicios de ciclismo de 100 min en estado estable (63% PPO) seguidos por 8 intervalos de 5 minutos a ritmo máximo ya sea 2 h (BAJO) o 24 h (ALTO) después. Contenido de glucógeno Pre-ejercicio intervalado: BAJO: 256; ALTO: 390. Contenido de glucógeno Post ejercicio: BAJO: 124; ALTO: 229.
|
Aumentos en la actividad CS y de β-HAD solo en la condición BAJO
Aumento en el contenido de proteínas COX IV solo en la condición BAJO. |
Mejoras similares (10%) en pruebas contrarreloj (TT) en ambos grupos. |
| Morton et al. [18] | 23 varones activos | 6 semanas
4 x semana |
Carreras 6 x 3 min (90% VO2máx.).
El grupo NORM entrenó una vez por día, mientras que los grupos BAJO+PLA y BAJO+GLU entrenaron dos veces por día (día por medio). El grupo BAJO+GLU consumió CHO antes y durante las segundas sesiones de entrenamiento Glucógeno Pre-ejercicio: BAJO: 232 y 253, ALTO: 412 y 387 en el gastrocnemio y vasto lateralis, respectivamente. Glucógeno post- ejercicio. BAJO: 107 y 176, ALTO: 240 y 262 en el gastrocnemio y vasto lateralis, respectivamente
|
Mayor incremento en la actividad SDH en el grupo BAJO+PLA en comparación con los grupos BAJO+GLU y NORM
|
Mejoras similares en VO2máx. y YoYoIR2 en todos los grupos
|
| Yeo et al. [23]
|
12 varones entrenados ciclistas / triatletas
|
Ejercicio agudo | Ejercicios de ciclismo en estado estable durante 100 min (63% PPO) seguidos por 8 intervalos de 5 minutos a ritmo máximo ya sea 2 h (BAJO) o 24 h (ALTO) mas tarde.
Glucógeno Pre-ejercicio intervalado: BAJO: 256, ALTO: 390. Glucógeno Post- ejercicio: BAJO: 124, ALTO: 229
|
Aumento en la Fosforilación de AMPKThr172 en el grupo BAJO
|
ND
|
| Hulston et al. [19] | 14 ciclistas varones entrenados | 3 semanas
6 x semana
|
Ejercicios de ciclismo de 90 min a 70% VO2máx. seguidos por (con un intervalo de 2h) HIT (8 x 5 min) en el grupo BAJO. El grupo ALTO realizó días alternados de ya sea ciclismo en estado estable o HIT. No se midió el nivel agudo de glucógeno
|
Incremento en el contenido de proteína β-HAD en el grupo BAJO solamente
Incremento en la utilización de las grasas a partir de los triglicéridos musculares solo en el grupo BAJO
|
Mejoras similares en pruebas contrarreloj (TT) de 60 min en ambos grupos
|
| Cochran et al. [22]
|
10 varones activos
|
Ejercicio agudo
|
HIT de ciclismo (5 x 4 min a 90–95% frecuencia cardíaca de reserva dos veces por día (con un intervalo de tiempo de 3h).
Un grupo consumió CHO(2,3g/kg) entre sesiones (ALTO), mientras que el otro grupo tuvo un consumo restringido de CHO (BAJO). Contenido de glucógeno antes de realizar los ejercicios de la tarde: BAJO: 256, ALTO: 390. Contenido de glucógeno luego de los ejercicios: BAJO: 124, ALTO: 229
|
Mayor fosforilación de p38MAPK en el grupo BAJO luego de los ejercicios de la tarde.
Incremento similar en la expresión génica de PGC-1α y COXIV
|
ND
|
| Cochran et al. [20]
|
18 Varones activos
|
2 semanas
3 días x semana |
HIT de ciclismo (5 x 4 min a 60% PPO) dos veces por día (con un intervalo de tiempo de separación de 3 h).
Un grupo consumió CHO (2,3 gramos/kg) entre sesiones (ALTO), mientras que el otro grupo tuvo un consumo restringido de CHO (BAJO). No se midió el nivel agudo de glucógeno
|
Incremento similar en la actividad máxima de CS y en el contenido de proteínas tanto de CS como de COXIV | Mayor incremento en el rendimiento de pruebas TT de 250 kJ en el grupo BAJO |
| Modelos de entrenamiento en condiciones de ayuno | |||||
| Akerstrom et al. [ 27]
|
9 varones activos
|
Ejercicio agudo
|
2 h de ejercicios para el musculo extensor de la rodilla con una sola pierna (60 % Wmax) ya sea en condiciones de ayuno (FAST) o alimentados (habiendo consumido CHO exógenos: FED)
Glucógeno Pre-ejercicio: 500 mmol /kg peso seco en ambos grupos. Glucógeno Post- ejercicio:300 y 200 en los grupos FED y FAST respectivamente
|
Menor actividad de AMPKα2 en el grupo FED | ND |
| Lee-Young et al. [49] | 9 varones activos | Ejercicio Agudo
|
120 min de ejercicios de ciclismo (65% VO2max) ya sea en estado de ayuno (FAST) o alimentados (consumo de CHO exógenos).
Glucógeno Pre-ejercicio: 500 mmol/kg peso seco en ambos grupos. Glucógeno Post-ejercicio 150 y 100 en los grupos FED y FAST respectivamente
|
Incrementos similares en la actividad de AMPKα2 y en la fosforilación de AMPKα2Thr172y de ACC-βSer222 | ND |
| Bock et al. [31]
|
20 Varones activos
|
6 semanas
3 x semana |
1-2 h de ciclismo (75% VO2max).
Un grupo entrenó en ayunas (FAST) mientras que el otro grupo consumió CHO antes y durante el ejercicio (FED). No se midió el nivel agudo de glucógeno
|
Incremento de FABP solamente en el grupo FAST | ND |
| Nybo et al. [32]
|
15 varones desentrenados
|
8 semanas
3-4 x semana |
3-6 min de intervalos de alta intensidad (70–85% VO2máx.). Los sujetos consumieron CHO o un placebo (PLA) durante el ejercicio.
No se determinó el nivel agudo de glucógeno
|
Mayor incremento en la actividad de β-HAD y en el contenido de glucógeno muscular basal solamente en el grupo PLA
|
Mejoras similares en la potencia máxima, VO2max y en el rendimiento en pruebas contrarreloj (TT) de15 minutos
|
| Van Proeyen et al [30]
|
20 varones activos
|
6 semanas
4 x semana
|
1–1,5 h de ciclismo (70% VO2máx.).
Un grupo realizó el entrenamiento en ayunas (FAST), mientras que el otro grupo consumió CHO antes y durante el ejercicio (FED). No se midió el nivel agudo de glucógeno
|
Se observó un aumento en la actividad máxima de CS y de β-HAD solo en el grupo FAST | Incrementos similares en el rendimiento de TT de 1 h en ambos grupos. |
| Modelo Dormir Bajo | |||||
| Pilegaard et al. [15]
|
Estudio A:
6 Varones activos Estudio B: 6 Varones activos
|
Ejercicio agudo
Ejercicio agudo |
Estudio A: Ejercicios de agotamiento de glucógeno para una sola pierna seguidos de ejercicios de ciclismo con ambas piernas (2h a 45% de VO2max) el día posterior. Glucógeno Pre-Ejercicio: BAJO: 337, ALTO: 609.
Glucógeno Post ejercicio: BAJO: 306, ALTO: 423 Estudio B: 3 h de ejercicios para los extensores de la rodilla con ambas piernas ya sea con contenido normal de glucógeno (NORM) o con contenido reducido (BAJO). Glucógeno Pre-ejercicio: BAJO: 240, ALTO: 398. Glucógeno Post-ejercicio: BAJO: 101, ALTO: 153
|
Estudio A: Mayor expresión génica de PDK4, LPL y HKII en reposo solo en la condición BAJO.
Estudios A y B: Mayor expresión génica de PDK4 y UCP3 post-ejercicio solo en el grupo BAJO. |
ND
ND |
| Wojtaszewski et al. [36]
|
8 varones entrenados
|
Ejercicio agudo
|
60 min de ciclismo a 70% VO2max ya sea con contenido de glucógeno muscular BAJO o ALTO (logrado mediante manipulación del ejercicio / dieta el día previo)
Glucógeno Pre-ejercicio BAJO: 163, ALTO: 909. Glucógeno Post ejercicio: BAJO: 150, ALTO: 400
|
Incremento en la actividad de AMPKα2 solo en el grupo BAJO
Mayor fosforilación de ACCSer221 en el grupo BAJO
|
ND |
| Chan et al. [37]
|
8 Varones activos
|
Ejercicio agudo
|
60 min de ciclismo (70% VO2max) con contenido de glucógeno ALTO o BAJO (logrado a través del manejo de ejercicio / dieta el día previo por la noche)
Glucógeno Pre-ejercicio BAJO: 163, ALTO: 375. Glucógeno Post ejercicio: BAJO:17, ALTO: 102
|
Mayor Fosforilación de p38MAPK en el grupo BAJO
Aumento en la expresión génica de IL-6 en el grupo BAJO
|
ND |
| Steinberg et al. [21]
|
7 varones activos.
|
Ejercicio agudo
|
60 min de ciclismo a 70% VO2máx con contenido de glucógeno muscular BAJO o NORMAL
Glucógeno Pre-ejercicio: BAJO: 150, ALTO: 390. Glucógeno post ejercicio BAJO: 17, ALTO: 111
|
Mayor actividad de AMPKα 2, fosforilación de ACCSer221 y translocación nuclear de AMPK
α2 en el grupo BAJO solamente Aumento en la expresión génica GLUT4 en el grupo BAJO |
ND
|
| Bartlett et al. [38] | 8 varones activos
|
Ejercicio agudo | HIT de Carrera (6 x 3 min a 90%VO2máx.).
El grupo BAJO realizó ejercicios de ciclismo para agotar el glucógeno y restringió los CHO durante la noche. El grupo ALTO consumió un desayuno con elevado contenido de CHO y consumió CHO durante el ejercicio. Glucógeno Pre-ejercicio: BAJO: 100, ALTO: 500. Glucógeno post-ejercicio: BAJO: 80, ALTO:300
|
Fosforilación de ACCSer79 y p53Ser15 en el grupo BAJO solamente
Aumento en la expresión génica de PGC-1α, PDK4, Tfam y COXIV en el grupo BAJO
|
ND
|
| Psilander et al. [24]
|
10 ciclistas varones entrenados
|
Ejercicio agudo | Ejercicios de ciclismo 6 x 10 min (64% VO2max.) con contenido de glucógeno ALTO o BAJO (logrado mediante manipulación del ejercicio/dieta durante las 14 horas previas). Glucógeno pre ejercicio: BAJO: 166; ALTO: 478. Glucógeno Post ejercicio: BAJO: 130; ALTO: 477 | Aumento en la expresión de los genes de PGC-1α en el grupo BAJO.
Aumento en la expresión de genes de PDK4 y COXIV en el grupo BAJO solamente
|
ND |
| Lane et al. [39] | 7 ciclistas varones entrenados | Ejercicio agudo | Serie de ciclismo de alta intensidad vespertina (8 x 5 min a 82,5% PPO) seguida por 120 min de ciclismo en estado estable (50% PPO) durante la mañana siguiente. El grupo BAJO restringió los carbohidratos durante la noche mientras que el grupo HIGH consumió una dieta con elevado contenido de CHO (4 g/kg de masa corporal.
Glucógeno pre ejercicio: BAJO: 349; ALTO: 459. Glucógeno Post ejercicio: BAJO: 266; ALTO: 338 |
Aumento en la fosforilación de ACC Ser79luego del ejercicio de la mañana subsiguiente en el grupo BAJO.
Aumento en la expresión de CD36, FABP3 y PDK4 luego del ejercicio de la mañana subsiguiente en el grupo BAJO
|
ND |
| Marquet et al. [40]
|
21 triatletas varones
|
3 semanas
6 x semana
|
HIT (8 x5 min ciclismo a 85% de potencia aeróbica máxima o 6 x 5 minutos de carrera con intensidad individual de 10 kilómetros) por la tarde seguidos por entrenamiento de baja intensidad (LIT) (60 minutos de ciclismo a 65% potencia aeróbica máxima) la mañana posterior
Un grupo consumió CHO entre las sesiones de entrenamiento (ALTO), mientras que el otro grupo tuvo un consumo restringido de CHO (BAJO). No se midió el nivel agudo de glucógeno |
ND | Aumento en el rendimiento de pruebas contrarreloj (TT) de carreras y mejor TTE en ciclismo (150 % potencia aeróbica máxima) solo en el grupo BAJO |
| Marquet et al. [41]
|
11 ciclistas varones entrenados | 1 semana
6 x semana
|
HIT (8 x5 minutos de ciclismo a 85% MAP) al atardecer seguido por entrenamiento de baja intensidad (LIT) (60 minutos ciclismo a 65% de potencia aeróbica máxima) en la mañana siguiente.
Un grupo consumió CHO entre las sesiones de entrenamiento (ALTO), mientras que el otro grupo tuvo un consumo restringido de CHO (BAJO). No se determinó el nivel de glucógeno agudo |
ND | Mejora en el rendimiento en pruebas contrarreloj (TT) de 20 kilómetros en el grupo BAJO solamente
|
| Modelo Recuperar-BAJO | |||||
| Pilegaard et al. [16]
|
9 Varones activos
|
Ejercicio Agudo
|
75 min de ciclismo (75%VO2máx.) seguido por 24h de recuperación con una dieta con ALTO o BAJO contenido de CHO.
El contenido de glucógeno se recuperó a valores de 576 y 348 con las dietas de ALTO y BAJO contenido de CHO respectivamente a las 24 horas |
La expresión génica de PDK4, UCP3, LPL y CPT1 se mantuvo elevada durante 8-24 h con la restricción de CHO post ejercicio
|
ND |
| Jensen et al [54]
|
15 varones triatletas
|
Ejercicio agudo | 4 horas de ciclismo (56%VO2máx.) seguidas por 4h de recuperación con alimentación con contenido de CHO ALTO (1g.kg.h) o BAJO (agua solamente).
Glucógeno Post-ejercicio: BAJO: 234, ALTO:245. Glucógeno luego de 4 horas BAJO:264, ALTO:444
|
Expresión génica similar de PGC-1α, Tfam, NRF-1, COXIV, PDK4, LPL, PPAR, UCP3 y GLUT4 en ambos grupos
|
ND |
| Alimentación rica en grasas | |||||
| Hammond et al. [43] | 10 varones activos
|
Ejercicio Agudo
|
Carreras de alta intensidad (8x 5min a 85%VO2max) seguidas por carrera en estado estable (60min a 70% de VO2max) 3,5h mas tarde.
Las carreras en estado estable se iniciaron con una disponibilidad de CHO ALTA o BAJA (pero con elevado contenido de grasas) El contenido de glucógeno muscular fue similar en ambos grupos (200mmol /kg peso seco) luego de la carrera en estado estacionario |
La actividad de p70S6K fue suprimida por la alimentación rica en grasas
Expresión génica similar de PGC-1α, p53, CS, Tfam, PPAR y ERRα en ambos grupos
|
ND |
| Modelo Periodizado | |||||
| Impey et al. [48]
|
11 Ciclistas varones aficionados
|
Ejercicio Agudo | Basado en el principio de “aporte de combustible para el trabajo requerido”.
4 x 30 s HIT de ciclismo (150% PPO) y 45 min de ciclismo en estado estable (50% PPO) seguidos por esfuerzos de 1 min (80% PPO) hasta el agotamiento ya sea con contenido de glucógeno ALTO o BAJO (por manejo de la dieta/ejercicio durante las 36 horas previas a la intervención). El grupo ALTO consumió carbohidratos antes, durante y después del ejercicio mientras que el grupo BAJO consumió proteína enriquecida con leucina
|
36 h antes de la restricción de CHO, aumentó la expresión génica de p53, SIRT1 y Tfam
La restricción de CHO antes y durante el ejercicio indujo una señalización de AMPK que favorecería la eficiencia del trabajo La restricción de CHO post ejercicio y el mantenimiento del nivel de glucógeno por debajo de 100 mmol/kg de peso seco redujo la actividad de p70S6K |
Se observaron mejoras en la capacidad de ejercicio (esfuerzos de 1 minuto a 80% PPO) en el grupo ALTO (158 vs. 100 min) |
| Burke et al. [45]
|
22 varonespedestristas de nivel internacional
|
3 semanas
7 x semana
|
3 semanas de entrenamiento intensificado (carrera, entrenamiento de la fuerza resistencia, entrenamiento cruzado).
Los atletas consumieron tres dietas diferentes durante el período de entrenamiento: (a) alto contenido de CHO; (b) LCHF; (c) ingesta de CHO periodizada con períodos de entrenamiento con bajo contenido de CHO No se determinó el nivel de glucógeno agudo
|
ND | Aumentos similares en VO2pico en todos los grupos.
Mejores tiempos de carrera de 10 km en los grupos ALTO consumo de CHO y consumo de CHO periodizado (no se observaron cambios en el grupo que siguió la dieta LCHF). La dieta LCHF aumentó el costo de O2 delpedestrismo
|
| Gejl et al. [55] | 26 varones, atletas de resistencia de elite | 4 semanas
7 x semana |
4 semanas de entrenamiento intensificado. Los atletas realizaron todas las sesiones con una elevada disponibilidad de CHO o implementaron un modelo periodizado donde realizaron tres sesiones por semana con una disponibilidad de CHO reducida. El contenido de glucógeno fue 400 mmol/kg de peso seco luego de las sesiones de entrenamiento con BAJO contenido de carbohidratos. | Aumentos similares en la actividad de CS.
No se observaron aumentos en la actividad de β-HAD en ninguno de los grupos |
Aumentos similares en VO2max y en el rendimiento de pruebas contrarreloj (TT) de 30 min en los grupos. |
Tabla 1. Visión general de los detalles metodológicos y resultados de estudios de entrenar bajo agudo y crónico conforme al paradigma pertinente entrenar bajo. β-HAD = Beta hidroaxiacil-CoA deshidrogenasa, ACC= Acetil CoA carboxilasa, AMPK= Proteína quinasa activada por AMP, BM= Masa Corporal, CHO= Carbohidratos, CD36= Antígeno de diferenciación 36, CPT1= Carnitina palmitoil transferasa 1, CS= Citrato sintasa, COX= Citocromo c oxidasa, ERRa Receptor a de unión a estrógenos, FABP3= Proteína de unión a ácidos grasos, GLU= Glucosa, GLUT4= Transportador de glucosa tipo 4, HIT= Entrenamiento de alta intensidad, HKII= Hexoquinasa II, IL= Interleukina, LCHF= Bajo en carbohidratos alto en grasas, LIT= Entrenamiento de baja intensidad, LPL= Lipasa lipoproteica, MAP= Potencia aeróbica máxima, ND= No disponible, NORM normal, NRF-1= Factor respiratorio nuclear 1, p38MAPK=Proteína quinasa p38 activada por mitógenos, p70S6K= Proteína quinasa ribosomal S6, PDK4= Piruvato deshidrogenasa quinasa 4, PGC-1α= Proteína 1α coactivadora del receptor gama activado por el proliferador de peroxisomas, PLA=Placebo, PM=post meridiano, PPAR= Receptor activado por el proliferador de peroxisomas, PPO= Producción de potencia máxima, SIRT1= Sirtuina 1 desacetilasa dependiente de NAD, SDH= Succinato deshidrogenasa, Tfam= Factor de transcripción A, TT= Prueba contrarreloj, TTE= Tiempo hasta el agotamiento, UCP3= Proteína desacoplante 3, VO2pico= Consumo de oxígeno pico, VO2max= Consumo de oxígeno máximo, Wmax=Watt máximo, YoYoIR2= Yo-Yo test de recuperación intermitente 2.
Alimentación Rica en Grasas
Además de manipular la disponibilidad de CHO, es posible que los aumentos asociados en la disponibilidad de ácidos grasos libres (FFA) circulantes también actúen como reguladores de las vías de señalización celular relevantes. De hecho, la activación de p38MAPK inducida por el ejercicio puede ser suprimida mediante la disminución farmacológica de la disponibilidad de FFA [42]. No obstante, aunque reconocemos el rol potencial de la señalización aguda mediada por FFA (como secundaria a la intervención principal de control a través de CHO), es poco probable que la restricción de CHO en combinación con una alimentación rica en grasas sea beneficiosa para las adaptaciones al entrenamiento.
De hecho, 1 a 5 días de alimentación rica en grasas reduce la expresión [43] y la actividad del complejo piruvato deshidrogenasa (PDH) [44], lo que en finalmente afecta la oxidación de CHO y el rendimiento en alta intensidad. Además, Burke et al. [45] realizaron un estudio con corredores de élite y observaron que la economía y el rendimiento deportivo se vieron afectados negativamente después de 3 semanas de una dieta alta en grasas en comparación con una disponibilidad de CHO periodizada y alta. Los datos disponibles también sugieren que la alimentación rica en grasas puede afectar la síntesis de proteínas musculares [46], probablemente a través de una menor activación de la señalización del blanco de rapamicina de mamíferos (mTOR) y de la señalización de la proteína quinasa ribosomal S6 (p70S6K) [43 ].
Fusión de Paradigmas de Entrenar Bajo y de Restricción Calórica Inducida por la Restricción de CHO
En el entorno real de los atletas de resistencia de élite, es probable que los atletas implementen una combinación de los paradigmas de entrenar bajo antes mencionados (ya sea por defecto de su estructura de entrenamiento habitual o por las prácticas de sus entrenadores y directores científicos deportivos), en lugar de implementar una estrategia de forma aislada. Además, los atletas de élite también pueden realizar entre 20 y 30 h de entrenamiento por semana, mientras que muchos de los diseños de estudio revisados hasta el momento han utilizado programas de entrenamiento con una duración inferior a 10 h por semana. La complejidad de los modelos prácticos de entrenar bajo se ve exacerbada por observaciones que los atletas de resistencia practican periodización de la energía día a día o con períodos de largo plazo (a diferencia del CHO per se) con el objetivo de reducir la masa y la grasa corporal cuando se preparan para las competencias [10, 47] (Morton, observaciones no publicadas). De hecho, las mejoras de rendimiento observadas por Marquet et al. [40] también se asociaron con una reducción de 1 kg en la masa grasa inducida por el modelo de sueño bajo. Independientemente de las reducciones en la masa corporal, es posible que muchas de las adaptaciones del músculo esquelético asociadas con el “entrenamiento bajo” estén mediadas por períodos repetidos y transitorios de restricción de energía y no por la restricción de CHO per se.
Observamos que la expresión post-ejercicio de la proteína1-α coactivadora del receptor activado por el proliferador de peroxisomas (PGC-1α), de p53, del factor de transcripción mitocondrial A (Tfam) y del ARN mensajero (ARNm) del receptor activado por proliferador de peroxisoma (PPAR) presentaron un aumento de similar magnitud y evolución en el tiempo cuando los atletas consumieron una dieta baja en CHO y dieta alta en grasas versus una dieta isoenergética alta en CHO [43]. Estos datos entran en conflicto con observaciones de nuestro laboratorio [38], donde observamos que la restricción de CHO y de calorías post ejercicio aumentó la expresión de muchos de los genes antes mencionados. Dada la similitud en las adaptaciones metabólicas entre la restricción de CHO y la restricción calórica, tales datos plantean el interrogante de si las mejores respuestas mitocondriales observadas durante el entrenamiento bajo se deben en realidad a períodos transitorios de restricción de calorías (mediada por una reducción en la ingesta de CHO) y no a la restricción de CHO per se. Este punto es especialmente relevante dado que muchos atletas de resistencia se presentan diariamente con períodos transitorios de restricción de CHO y de calorías debido a múltiples sesiones de entrenamiento por día, así como con períodos de largo plazo con disponibilidad de energía sub óptima [47].
| Cambio Positivo | Sin cambio / equivalente | Cambio Negativo | |
| Músculo (n = 25) | |||
| Señalización (n = 11) | 73% (n=8)
Steinberg et al. [21] Cochran et al. [22] Yeo et al. [23] Akerstrom et al. [27] Wojtaszewski et al. [36] Chan et al. [37] Bartlett et al. [38] Lane et al. [39] |
27% (n=3)
Hammond et al. [ 43] Impey et al. [48] Lee-Young et al. [49]
|
0%
|
| Expresión genética (n = 12)
|
75% (n = 9)
Pilegaard et al. [15a, b] Pilegaard et al. [dieciséis] Steinberg et al. [21] Psilander et al. [24] Chan et al. [37] Bartlett et al. [38] Lane et al. [39] Impey et al. [48] |
25% (n = 3)
Cochran et al. [22] Hammond et al. [ 43] Jensen et al. [54]
|
0%
|
| Actividad enzimática /contenido de proteínas (n = 9)
|
78% (n = 7)
Hansen et al. [9] Yeo et al. [17] Morton et al. [18] Hulston et al. [19] Van Proeyen et al. [30] De Bock et al. [ 31] Nybo et al. [32]
|
22% (n = 2)
Cochran et al. [20] Gejl et al. [52]
|
0%
|
| Respuestas fisiológicas | |||
| Oxidación de lípidos (n = 17) | 47% (n = 8)
Yeo et al. [17] Hulston et al. [19] Akerstrom et al. [27] Wojtaszewski et al. [36] Bartlett et al. [38] Lane et al. [39] Hammond et al. [ 43] Impey et al. [48 ] |
53% (n=9)
Pilegaard et al. [15 a] Marquet et al. [40, 41] Van Proeyen et al. [30] De Bock et al. [31] Nybo et al. [32] Burke et al. [45] Lee-Young et al. [49] Gejl et al. [52]
|
0%
|
| Eficiencia/economía (n = 2) | 50% (n = 1)
Marquet et al. [40]
|
50% (n = 1)
Burke et al. [45]
|
|
| Rendimiento | |||
| Cambios en el rendimiento en ejercicios (n =11)
|
37% (n = 4)
Hansen et al. [9] Cochran et al. [20] Marquet et al. [40, 41]
|
63% (n = 7)
Yeo et al. [17] Morton et al. [18] Hulston et al. [19] Van Proeyen et al. [30] Nybo et al. [32] Burke et al. [45] Gejl et al. [52]
|
0%
|
| Intensidad de entrenamiento disminuida (n = 3)
|
0%
|
0%
|
100% (n = 3)
Yeo et al. [17] Hulston et al. [19] Lane et al. [56]
|
Tabla 2. Resumen de los resultados clave de los estudios de entrenamiento bajo clasificados en función de las variables analizadas de señalización celular, expresión génica, cambios enzimáticos y resultados de rendimiento. Los estudios se presentan agrupados en función a si observaron cambios positivos, cambios negativos o si no se observaron cambios.
Hipótesis del Umbral de Glucógeno: Las Adaptaciones Musculares y de Rendimiento Asociadas con la Restricción de CHO se Producen dentro de un Intervalo de Concentraciones Absolutas de Glucógeno Muscular
Debido a que la mejor respuesta de entrenamiento que se asocia con ‘entrenar bajo’ está potencialmente mediada por la disponibilidad de glucógeno muscular, es prudente considerar las concentraciones absolutas de glucógeno necesarias para facilitar la respuesta. Al respecto, el examen de los estudios disponibles con entrenamiento bajo (ver Tabla 1) demuestran que las adaptaciones asociadas con la restricción de CHO son particularmente evidentes cuando las concentraciones de glucógeno muscular absolutas previas al ejercicio son ≤300 mmol/kg peso seco. Sin embargo, la recuperación de los niveles de glucógeno después del ejercicio a valores >500 mmol/kg de peso seco atenúa los cambios inducidos por el ejercicio en la expresión génica [16], y el mantenimiento del glucógeno (y la energía) en niveles post-ejercicio críticamente bajos (es decir, <100 mmol /kg de peso seco) puede reducir la regulación de las vías de síntesis de proteínas [48]. El consumo de CHO durante el ejercicio también atenúa la señalización mediada por AMPK, pero solo cuando se produce ahorro de glucógeno [27, 49]. Sin embargo, cabe señalar que iniciar los ejercicios con valores <200 mmol/kg de peso seco afecta la intensidad de entrenamiento debido a la falta de sustrato muscular y afecta la capacidad contráctil de las células musculares a través de la alteración en la regulación del calcio [50-52]. Además, el entrenamiento repetitivo diario con reducción en la disponibilidad de CHO (como para reducir la concentración de glucógeno muscular antes del ejercicio) puede aumentar la susceptibilidad a las enfermedades [53]. Sobre esta base, tales datos sugieren la existencia de un umbral de glucógeno muscular donde es necesario inducir un nivel absoluto crítico de agotamiento de glucógeno para una activación significativa de las vías de señalización celular que se produzcan con la condición, por supuesto, de que la carga de trabajo y la intensidad de entrenamiento deseadas puedan ser alcanzadas sin ninguna mala adaptación. De esta manera, el umbral de glucógeno proporciona una ventana metabólica de concentraciones de glucógeno muscular (por ejemplo, 300-100 mmol/kg peso seco) que es permisiva para facilitar la intensidad de entrenamiento requerida, las respuestas de señalización celular aguda y los procesos de remodelación post-ejercicio (ver Figura 2). No obstante, la presencia potencial de un umbral de glucógeno no quiere decir que los individuos no se adaptarán al entrenamiento de resistencia si no realizan el ejercicio dentro del umbral sugerido. Más bien, tal umbral refleja la posibilidad de que las mejores adaptaciones asociadas con “entrenar bajo” son especialmente prominentes una vez que se ha producido un cierto nivel de agotamiento de glucógeno. También reconocemos la existencia de variación entre sujetos en el agotamiento del glucógeno que a menudo se observa en la literatura y el modo en que esto también puede influir en cualquier intervalo potencial de umbral de glucógeno (las respuestas de los sujetos individuales se presentan en la Figura 2 con datos obtenidos en el laboratorio de los autores).
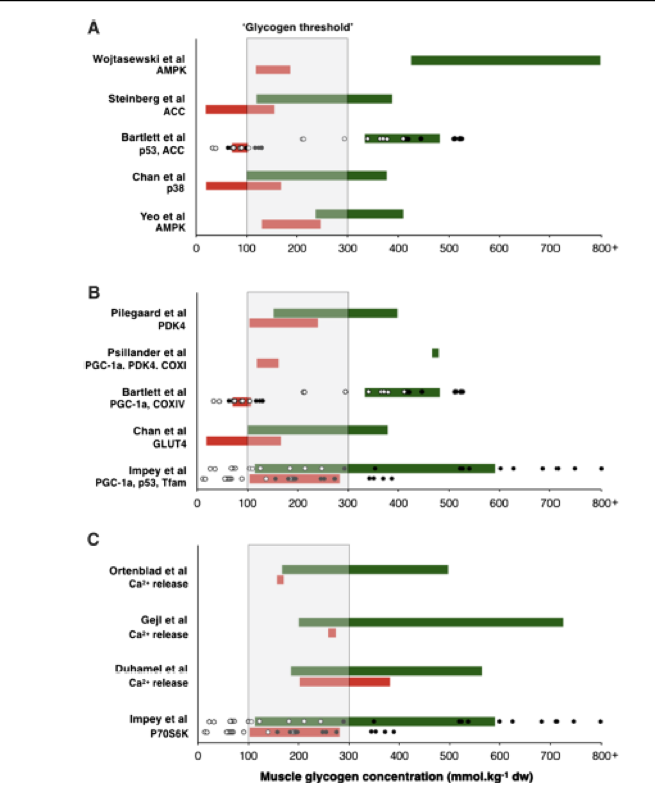
Muscle glycogen concentration (mmol kg-1 dw-1)= Concentración muscular de glucógeno (mmol kg-1 peso seco-1); Glycogen threshold = Umbral de glucógeno; Ca+2 release= Liberación de Ca+2
Figura 2. Resumen de los estudios que apoyan la hipótesis del umbral de glucógeno. Los estudios se clasifican en aquellos que analizaron: a señalización celular, b expresión génica y c capacidad contráctil del músculo y señalización post-ejercicio. En a y b, las barras verdes representan la prueba dentro del estudio específico que se realizó con un nivel de glucógeno muscular alto y las barras rojas representan las pruebas realizadas con un nivel de glucógeno muscular bajo. En ambos casos la longitud de la barra corresponde a la concentración de glucógeno muscular antes y después del ejercicio. Adicionalmente, en estudios del laboratorio de los autores (Bartlett et al. [38] e Impey et al. [48]), los círculos en blanco y negro representan concentraciones de glucógeno muscular de los sujetos antes y después del ejercicio, respectivamente. En c, se aplicaron diferentes protocolos de manipulación de CHO para analizar el efecto que tenían las concentraciones de glucógeno muscular altas (barras verdes) y bajas (barras rojas) sobre las propiedades contráctiles y de señalización post-ejercicio. El área sombreada representa un potencial umbral de glucógeno muscular en el cual se debe comenzar el ejercicio (aunque específico para el nivel de entrenamiento de los participantes estudiados en estas investigaciones). AMPK= Proteína quinasa activada por AMP, ACC=Acetil- CoA carboxilasa, Ca+2= Calcio, COX= Citocromo c oxidasa, p38MAPK= Proteína quinasa p38 activada por mitógenos, p70S6K=Proteína quinasa ribosomal S6, PDK4= Piruvato deshidrogenasa quinasa 4, PGC-1α=Proteína 1α coactivadora del receptor gama activado por el proliferador de peroxisomas, Tfam= Factor de transcripción mitocondrial A.
Aporte de Combustible para el Trabajo Requerido: Aplicación Práctica de la Hipótesis del Umbral de Glucógeno
Los estudios revisados hasta ahora implementaron protocolos de ejercicio de trabajo combinados mediante los cuales la disponibilidad de CHO se manipula antes de las sesiones de entrenamiento de idéntica intensidad, duración y trabajo realizado. Recientemente, también adoptamos un diseño experimental en el que los participantes completaron una prueba exhaustiva de la capacidad de ejercicio en condiciones de glucógeno muscular pre-ejercicio alto o bajo (600 y 300 mmol/kg de peso seco, respectivamente) [48]. Todos los participantes pedalearon más tiempo en el grupo con carbohidratos altos que en el de carbohidratos bajos, y se observó una capacidad de ejercicio media aumentada en 60 min. Nosotros observamos señalización celular y respuestas génicas post ejercicio similares entre las condiciones (por ejemplo, AMPK-PGC-1a) a pesar de que en la condición con glucógeno bajo se realizó menos trabajo. Sin embargo, es necesario destacar que para estimular otras adaptaciones relacionadas con la resistencia (por ejemplo, cambios centrales como hipertrofia cardíaca), las condiciones de alto glucógeno serían superiores, dado que permitirían la realización de más trabajo y, por supuesto, una frecuencia cardíaca más alta para una duración de entrenamiento mucho más larga. Además, a nivel muscular, aparentemente comenzar el ejercicio con un elevado contenido de glucógeno muscular requiere que se realice una cantidad de trabajo considerablemente mayor para obtener respuestas de señalización celular y de remodelación muscular comparables a las que se producen cuando el ejercicio se inicia con un contenido de glucógeno muscular bajo. En esta situación, se sugiere que los sujetos eventualmente sobrepasen un nivel crítico de agotamiento de glucógeno, completando así una proporción del ejercicio dentro del umbral de glucógeno necesario para estimular la señalización celular. Dado que los atletas de resistencia de élite rara vez implementan sesiones idénticas o entrenan con intensidad máxima (o hasta el agotamiento) en sesiones de entrenamiento consecutivas, ya sea en un mismo día o en días diferentes, estos datos apoyan el concepto de “aporte de combustible para el trabajo requerido “, donde la disponibilidad de CHO se ajusta de acuerdo con las demandas de la sesión de entrenamiento que debe ser realizada. De esta manera, la ingesta absoluta y la distribución de CHO se pueden modificar para que las sesiones clave se realicen en o cerca del umbral de glucógeno muscular sugerido. Tal como inicialmente aludieron Sherman et al. [6], la pregunta que surge es no ¿cuánto un atleta puede sobrecompensar su reserva de glucógeno?, sino si la dieta del atleta contiene suficiente CHO para mantener la intensidad del entrenamiento al tiempo que se genera un medio metabólico consistente que facilite las adaptaciones al entrenamiento. Utilizando el ciclismo de ruta, presentamos una descripción teórica del modelo la Tabla 3.
| Cronograma para el aporte de carbohidratos | ||||
| Sesiones de entrenamiento | Comida previa al entrenamiento | Comida consumida durante el entrenamiento | Comida consumida luego del entrenamiento | Comida consumida al atardecer |
| Día 1
sesiones de alta intensidad de 4-6 horas que consisten en varios intervalos > al umbral del lactato |
ALTA | ALTA | ALTA | BAJA |
| Día 2
sesiones de baja intensidad de 3-5 horas en estado estable con una intensidad < al umbral del lactato |
BAJA | BAJA | ALTA | ALTA |
| Día 3
Sesiones de alta intensidad de 3 horas con múltiples intervalos > al umbral del lactato |
ALTA | MEDIA | ALTA | MEDIA |
| Día 4
Sesión de recuperación con una duración inferior a 1 hora con una intensidad < al umbral del lactato |
BAJA | BAJA | ALTA | ALTA |
Tabla 3. Descripción teórica del modelo de “aporte de combustible para el trabajo requerido”.
Este modelo fue diseñado para un atleta de resistencia (e.j. ciclista de ruta) que entrenaba una vez al día durante 4 días consecutivos, donde cada sesión comenzaba a las 10:00 am cada día. En este ejemplo, se fijaron cuatro momentos de consumo de alimentos y el contenido de carbohidratos de cada momento está simbolizado por una categoría de color; rojo, amarillo o verde (RAG) que representa la ingesta de carbohidratos (CHO) baja, media o alta respectivamente. Es importante destacar que no especificamos ninguna cantidad específica de CHO y hemos elegido deliberadamente una categoría RAG con el fin de señalar la importancia de ser flexibles en relación a los antecedentes de los atletas, del estado de entrenamiento, de las metas de entrenamiento específicas, etc. de cada atleta. El modelo se presenta simplemente para reflejar como los paradigmas de entrenar bajo pueden ser combinados para ajustar la disponibilidad de carbohidratos día por día y comida por comida a las demandas de las sesiones de entrenamiento específicas durante un bloque de entrenamiento de 4 días. En este ejemplo. Se recomienda una elevada ingesta de CHO antes, durante y después de la sesión de entrenamiento el día 1 (ej. Entrenar alto), pero reducida en la comida del atardecer para facilitar la condición de dormir bajo y entrenar bajo el día 2 en la sesión de menor intensidad (probablemente comenzar con un contenido de glucógeno muscular bajo y suspender o reducir el contenido de CHO de la comida pre-entrenamiento). Luego de realizar la segunda sesión de entrenamiento, se recomienda una elevada disponibilidad de CHO para el resto del día 2 con el fin de promover el almacenamiento de glucógeno y prepararse para la mayor intensidad y la mayor carga de trabajo absoluta del día 3. Dado que el día 4 es un día asignado a la recuperación de menor duración y menor intensidad, la ingesta de CHO debe reducirse durante el atardecer del día 3 y durante el desayuno del día 4, pero debe incrementarse durante el resto del día 4 para poder prepararse para otro bloque de entrenamiento de 4 días. El modelo debe ser adaptado en función de la cantidad de momentos de alimentación y de las sesiones de entrenamiento que serán implementadas cada día. Ej un corredor de maratón (7) tendrá un modelo de periodización de CHO diferente al de un ciclista. La cuidadosa periodización día por día, comida por comida (de manera opuesta a los períodos crónicos de restricción de CHO o de aporte de CHO) probablemente permita conservar una flexibilidad metabólica y además permita completar cargas de trabajo de alta intensidad y duración prolongada los días de entrenamiento pesados, ej. Sesiones de tipo intervalado realizadas por encima del umbral del lactato. Intuitivamente, el modelo “entrenar bajo” debería ser destinado a aquellas sesiones de entrenamiento que no dependen de los CHO y donde la intensidad y duración no se vean afectadas por una disponibilidad reducida de CHO (ej. Sesiones de entrenamiento de tipo estado estacionario realizadas con intensidad por debajo del umbral del lactato). Adicionalmente, el modelo podría aportar un marco de referencia para ayudar a perder peso dado que las sesiones de entrenamiento bajo o los días de entrenamiento de menor intensidad favorecen la aparición de déficits de energía sin afectar la intensidad de entrenamiento.
Reflexiones Críticas y Limitaciones sobre la Aplicación Práctica de la Hipótesis del Umbral de Glucógeno
A pesar de la justificación teórica de las sesiones de entrenamiento bajo y de la presencia potencial de un umbral de glucógeno, existen muchos desafíos obvios para que esto pueda cobrar vida en la práctica aplicada. Fundamentalmente, no tenemos una detallada comprensión del costo de glucógeno y de CHO de las sesiones de entrenamiento habituales que realizan los atletas de élite, lo que limita nuestra capacidad para prescribir sesiones de entrenamiento que puedan generar algún umbral de glucógeno. De hecho, las tasas de utilización de glucógeno no son lineales y dependen de la disponibilidad de sustratos, del estado, la intensidad y la duración del entrenamiento, todos los cuales pueden modificar la regulación de la glucogenólisis a través de control hormonal o de la regulación alostérica. Además, es probable que cualquier umbral de glucógeno potencial sea específico del estado de entrenamiento y tenga una fuerte dependencia de las características de la modalidad de ejercicio en cuestión, por ejemplo, un umbral absoluto mas bajo puede presentarse en un deporte de base metabólica. como el ciclismo (una actividad sin desplazamiento de carga con una menor carga excéntrica), mientras que en las carreras puede presentarse un umbral más alto, porque comprende traslado de cargas, contracciones excéntricas y cargas neuromusculares más altas. Si bien el análisis de los estudios pertinentes (véase la Figura 3 para un muestreo de datos experimentales de estudios de ciclismo) nos aporta alguna indicación de la intensidad y duración (contra información sobre las diferencias en el nivel de glucógeno antes del ejercicio) que serían necesarios para agotar adecuadamente el glucógeno de un atleta cerca o en el umbral de glucógeno, debemos hacer suposiciones considerables. De hecho, debido a la falta de tecnología disponible para cuantificar de forma no invasiva el glucógeno muscular, la aplicación práctica de la hipótesis del umbral de glucógeno se basa en gran medida en los conocimientos teóricos de los profesionales sobre la utilización del glucógeno en sus deportes y, además es imprescindible contar con una evaluación detallada de las cargas de entrenamiento y de la ingesta de macronutrientes de los días previos para formular una guía adecuada para las futuras sesiones de entrenamiento. Para ello, el conocimiento de la bibliografía específica de deportes relevantes junto con la evaluación tanto de la carga de entrenamiento externa (por ejemplo, producción de potencia, velocidades de carrera) e interna (por ejemplo, frecuencia cardíaca, índice de esfuerzo percibido) pueden ser utilizados junto con evaluaciones teóricas de la utilización de sustratos para estimar el costo potencial de CHO de las sesiones de entrenamiento en el mundo real. También es probable que exista un debate considerable entre investigadores y profesionales en cuanto a la cantidad de CHO dietarios que coinciden con las categorías rojo, ámbar y verde (RAG) establecidas en la Tabla 3, y, sin duda, es necesario realizar muchos mas estudios específicos de diferentes deportes.
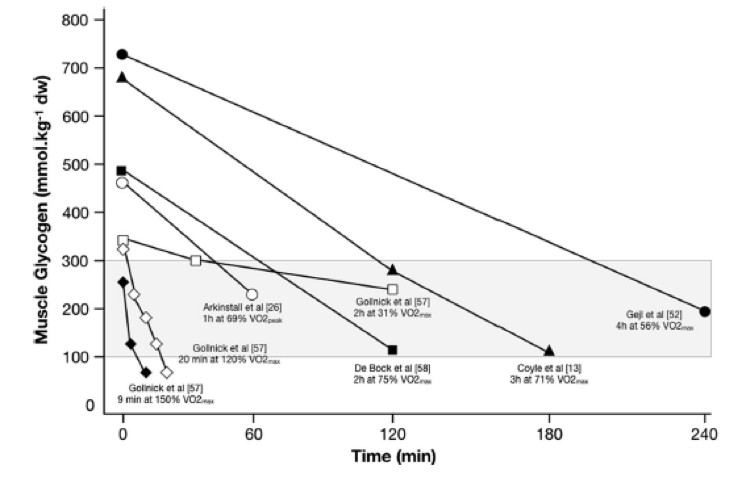
Time (min)= Tiempo (min); Muscle glycogen (mmol kg-1 dw) = Glucógeno muscular (mmol kg-1 peso seco).
Figura 3. Utilización del glucógeno muscular según los estudios que contemplaron ejercicios de diferentes intensidades y duraciones, y diferentes concentraciones de glucógeno muscular pre-ejercicio. Estos datos reflejan la manera en que puede variar el patrón de consumo de glucógeno (en función de los efectos interactivos de los parámetros mencionados previamente) y como debería considerarse esto en relación al umbral de glucógeno propuesto (área sombreada). Los datos se obtuvieron a partir de una muestra de estudios recopilados que solamente contemplaron protocolos de ejercicios para ciclismo y determinaron el consumo de glucógeno en el musculo vastus lateralis.
Conclusiones
La aparición de la disponibilidad de CHO (específicamente, de la concentración de glucógeno) como regulador de la adaptación al entrenamiento es actualmente un área reconocida de investigación que tiene implicaciones para las estrategias de entrenamiento de los atletas. Si bien esto es un tema candente entre atletas, entrenadores y científicos del deporte, la estrategia de periodización óptima para implementar períodos de restricción de CHO en un programa de entrenamiento general no ha sido descripta detalladamente. Además, los modelos prácticos de periodización de CHO (y energía) probablemente son muy específicos de la estructura de entrenamiento y de la cultura del deporte en cuestión, así como de los objetivos de entrenamiento específicos del atleta. En consecuencia, simplemente hemos presentado un marco hipotético de cómo debería ser el aporte de combustible para el trabajo requerido para reflejar como se podrían fusionar los modelos individuales de entrenamiento bajo para producir un manejo día a día y comida por comida de la disponibilidad de CHO. Si bien reconocemos fácilmente la necesidad de contar con modelos específicos para cada deporte y estudios de entrenamiento a largo plazo (especialmente para demostrar si las adaptaciones musculares al entrenamiento bajo realmente se correlacionan con cambios significativos en el rendimiento físico), también planteamos varias preguntas fundamentales que son relevantes en muchos modelos deportivos. Primero, ¿existe realmente un umbral de glucógeno muscular ‘graduado’ y, de ser así, ¿cómo se ve afectado por el estado de entrenamiento?
En segundo lugar, ¿las sesiones de entrenamiento bajo siempre deben ser sesiones de intensidad o es la finalización deliberada de una sesión de alta intensidad (incluso a expensas de una potencial reducción de la carga de trabajo absoluta) lo que realmente se necesita para crear el medio metabólico propicio para la señalización?
En tercer lugar, ¿cuál es la ingesta mínima de CHO y la concentración de glucógeno requerida para realizar períodos de “entrenamiento bajo” sin comprometer la intensidad absoluta del entrenamiento durante sesiones específicas? Cuarto, ¿la mejor respuesta al entrenamiento está asociada con un “entrenamiento bajo” regulado por la restricción de CHO y/o de energía? y, si es esto así, ¿cómo periodizamos y estructuramos tales intervenciones de entrenamiento sin inducir desadaptaciones? Finalmente, ¿existen nuevos blancos moleculares y modificaciones/ localización de proteínas que también interviene en la regulación de nutrientes y en las vías de señalización que responden al ejercicio? Teniendo esto en cuenta, debemos destacar que el estudio de solo 500g de sustrato (aproximadamente la reserva de CHO de todo el cuerpo) sigue siendo tan emocionante como siempre.
Conflicto de intereses
Samuel Impey, Mark Hearris, Kelly Hammond, Jonathan Bartlett, Julien Louis, Graeme Close y James Morton afirman que no poseen ningún conflicto de interés.
Financiamiento: No se recibió ningún subsidio para preparar y confeccionar este manuscrito.
Cita Original
Samuel G. Impey, Mark A. Hearris, Kelly M. Hammond, Jonathan D. Bartlett, Julien Louis, Graeme L. Close, James P. Morton. 2018. Fuel for the Work Required: A Theoretical Framework for Carbohydrate Periodization and the Glycogen Threshold Hypothesis. 2018. Sports Med. https://doi.org/10.1007/s40279-018-0867-7.
Referencias
- Thomas DT, Erdman KA, Burke LM. American college of sports medicine joint position statement. nutrition and athletic perfor- mance. Med Sci Sports Exerc. 2016;48:543–68.
- Bergstrom J, Hermansen L, Hultman E, Saltin B. Diet, muscle glycogen and physical performance. Acta Physiol Scand 1967;71:140–50.
- Bergstrom J, Hultman E. Muscle glycogen synthesis after exer- cise: an enhancing factor localized to the muscle cells in man. Nature. 1966;16:309–10.
- Bergstrom J, Hultman E. The effect of exercise on muscle glycogen and electrolytes in normals. Scand J Clin Lab Invest. 1966;18:16–20.
- Hermansen L, Hultman E, Saltin B. Muscle glycogen during prolonged severe exercise. Acta Physiol Scand. 1967;71:129–39.
- Sherman WM, Costill DL, Fink WJ, Miller JM. Effect of exer- cise-diet manipulation on muscle glycogen and its subsequent utilization during performance. Int J Sports Med. 1981;2:114–8.
- Sherman WM, Wimer GS. Insufficient dietary carbohydrate during training? Does it impair athletic performance? Int J Sport Nutr. 1991;1:28–44.
- Sherman WM, Doyle JA, Lamb DR, Strauss RH. Dietary car- bohydrate, muscle glycogen, and exercise performance during 7 days of training. Am J Clin Nutr. 1993;57:27–31.
- Hansen AK, Fischer CP, Plomgaard P, Andersen JL, Saltin B, Pedersen BK. Skeletal muscle adaptation: training twice every second day vs. training once daily. J Appl Physiol. 2005;98:93–9.
- Stellingwerff T. Case Study: nutrition and training periodization in three elite marathon runners. Int J Sport Nutri Exerc Metab. 2012;22:392–400.
- Hawley JA, Morton JP. Ramping up the signal: promoting endurance training adaptation in skeletal muscle by nutritional manipulation. Clin Exp Pharmacol Physiol. 2014;41:608–13.
- Bartlett JD, Hawley JA, Morton JP. Carbohydrate availability and exercise training adaptation: too much of a good thing? Eur J Sport Sci. 2015;15:3–12.
- Coyle EF, Coggan AR, Hemmert MK, Ivy JL. Muscle glycogen utilization during strenuous exercise when fed carbohydrate. J Appl Physiol. 1986;61:165–72.
- Wildrick JJ, Costill DL, Fink WJ, Hickey MS, McConnell GK, Tanaka H. Carbohydrate feedings and exercise performance: effect of initial muscle glycogen concentration. J Appl Physiol. 1993;74:2998–3005.
- Pilegaard H, Keller C, Steensberg A, Helge JW, Pedersen BK, Saltin B, Neufer PD. Influence of pre-exercise muscle glycogen content on exercise-induced transcriptional regulation of meta- bolic genes. J Physiol. 2002;541:261–71.
- Pilegaard H, Osada T, Andersen LT, Helge JW, Saltin B, Neufer PD. Substrate availability and transcriptional regulation of metabolic genes in human skeletal muscle during recovery from exercise. Metabolism. 2005;54:1048–55.
- Yeo WK, Paton CD, Garnham AP, Burke LM, Carey AL, Hawley JA. Skeletal muscle adaptation and performance responses to once versus twice every second day endurance training regimens. J Appl Physiol. 2008;105:1462–70.
- Morton JP, Croft L, Bartlett JD, MacLaren DP, Reilly T, Evans L, McArdle A, Drust B. Reduced carbohydrate availability does not modulate training-induced heat shock protein adaptations but does up regulate oxidative enzyme activity in human skeletal muscle. J Appl Physiol. 2009;106:1513–21.
- Hulston CJ, Venables MC, Mann CH, Martin C, Philp A, Baar K, Jeukendrup AE. Training with low muscle glycogen enhances fat metabolism in well-trained cyclists. Med Sci Sports Exerc. 2010;42:2046–55.
- Cochran AJ, Myslik F, Maclnnis MJ, Percival ME, Bishop D, Tarnopolsky MA, Gibala MJ. Manipulating carbohydrate avail- ability between twice-daily sessions of high-intensity interval training over 2 weeks improves time-trial performance. Int J Sport Nutr Exerc Metab. 2015;25:463–70.
- Steinberg GR, Watt MJ, McGee SL, Chan S, Hargreaves M, Febbraio MA, Stapleton D, Kemp BE. Reduced glycogen avail- ability is associated with increased AMPKalpha2 activity, nuclear AMPKalpha2 protein abundance, and GLUT4 mRNA expression in contracting human skeletal muscle. Appl Physiol Nutr Metab. 2006;31:302–12.
- Cochran AJ, Little JP, Tarnopolsky MA, Gibala MJ. Carbohy- drate feeding during recovery alters the skeletal muscle metabolic response to repeated sessions of high-intensity interval exercise in humans. J Appl Physiol. 2010;108:628–36.
- Yeo WK, McGee SL, Carey AL, Paton CD, Garnham AP, Har- greaves M, Hawley JA. Acute signalling responses to intense endurance training commenced with low or normal muscle glycogen. Exp Physiol. 2010;95:351–8.
- Psilander N, Frank P, Flockhart M, Sahlin K. Exercise with low glycogen increases PGC-1a gene expression in human skeletal muscle. Eur J Appl Physiol. 2013;113:951–63.
- Horowitz JF, Mora-Rodriguez R, Byerley LO, Coyle EF. Lipolytic suppression following carbohydrate ingestion limits fat oxidation during exercise. Am J Physiol. 1997;273:768–75.
- Arkinstall MJ, Bruce CR, Nikolopoulos V, Garnham AP, Hawley
- Effect of carbohydrate ingestion on metabolism during run- ning and cycling. J Appl Physiol. 2001;91:2125–34.
- Akerstrom TCA, Birk JB, Klein DK, Erikstrup C, Plomgaard P, Pedersen BK, Wojtaszewski J. Oral glucose ingestion attenuates exercise-induced activation of 50 -AMP-activated protein kinase in human skeletal muscle. Biochem Biophys Res Commun. 2006;342:949–55.
- Civitarese AE, Hesselink MK, Russell AP, Ravussin E, Schrau- wen P. Glucose ingestion during exercise blunts exercise-induced gene expression of skeletal muscle fat oxidative genes. Am J Physiol Endocrinol Metab. 2005;289:1023–9.
- Cluberton LJ, McGee SL, Murphy RM, Hargreaves M. Effect of carbohydrate ingestion on exercise-induced alterations in meta- bolic gene expression. J Appl Physiol. 2005;99:1359–63.
- Van Proeyen K, Szlufcik K, Nielens H, Ramaekers M, Hespel P. Beneficial metabolic adaptations due to endurance exercise training in the fasted state. J Appl Physiol. 2011;110:236–45.
- De Bock K, Derave W, Eijnde BO, Hesselink MK, Koninckx E, Rose AJ, Schrauwen P, Bonen A, Richter EA, Hespel P. Effect of training in the fasted state on metabolic responses during exercise with carbohydrate intake. J Appl Phyiol. 2008;104:1045–55.
- Nybo L, Pedersen K, Christensen B, Aagaard P, Brandt N, Kiens
- Impact of carbohydrate supplementation duringendurance training on glycogen storage and performance. Acta Physiol. 2009;197:117–27.
- Impey SG, Smith D, Robinson AL, Owens DJ, Bartlett JD, Smith K, Limb M, Tang J, Fraser WD, Close GL, Morton JP. Leucine- enriched protein feeding does not impair exercise-induced free fatty acid availability and lipid oxidation: beneficial implications for training in carbohydrate-restricted states. Amino Acids. 2015;47:407–16.
- Taylor C, Bartlett JD, van de Graaf CS, Louhelainen J, Coyne V, Iqbal Z, MacLaren DP, Gregson W, Close GL, Morton JP. Pro- tein ingestion does not impair exercise-induced AMPK signalling when in a glycogen-depleted state: implications for train-low compete-high. Eur J Appl Physiol. 2013;113:1457–68.
- Hulston CJ, Wolsk E, Grøndahl TS, Yfanti C, Van Hall G. Pro- tein intake does not increase vastus lateralis muscle protein synthesis during cycling. Med Sci Sports Exerc. 2011;43:1635–42.
- Wojtaszewski JF, MacDonald C, Nielsen JN, Hellsten Y, Hardie DG, Kemp BE, Kiens B, Richter EA. Regulation of 50 AMP- activated protein kinase activity and substrate utilization in exercising human skeletal muscle. Am J Physiol Endocrinol Metab. 2003;284:E812–22.
- Chan S, McGee SL, Watt MJ, Hargreaves M, Febbraio MA. Altering dietary nutrient intake that reduces glycogen content leads to phosphorylation of nuclear p38 MAP kinase in human skeletal muscle: association with IL-6 gene transcription during contraction. FASEB J. 2004;18:1785–7.
- Bartlett JD, Louhelainen J, Iqbal Z, Cochran AJ, Gibala MJ, Gregson W, Close GL, Drust B, Morton JP. Reduced carbohy- drate availability enhances exercise-induced p53 signalling in human skeletal muscle: implications for mitochondrial biogene- sis. Am J Physiol Regul Integr Comp Physiol. 2013;304:450–8.
- Lane SC, Camera DM, Lassiter DG, Areta JL, Bird SR, Yeo WK, Jeacocke NA, Krook A, Zierath JR, Burke LM, Hawley JA. Effects of sleeping with reduced carbohydrate availability on acute training responses. J Appl Physiol. 2015;119:643–55.
- Marquet LA, Brisswalter J, Louis J, Tiollier E, Burke LM, Hawley JA, Hausswirth C. Enhanced endurance performance by periodization of carbohydrate intake: ‘‘Sleep low’’ strategy. Med Sci Sports Exerc. 2016;48:663–72.
- Marquet LA, Hausswirth C, Molle O, Hawley JA, Burke LM, Tiollier E, Brisswalter J. Periodization of carbohydrate intake: short-term effect on performance. Nutrients. 2016;8:755.
- Zbinden-Foncea H, van Loon LJ, Raymackers JM, Francaux M, Deldicque L. Contribution of nonesterified fatty acids to mitogen- activated protein kinase activation in human skeletal muscle during endurance exercise. Int J Sport Nutr Exerc Metab. 2013;23:201–9.
- Hammond KM, Impey SG, Currell K, Mitchell N, Shepherd SO, Jeromson S, Hawley JA, Close GL, Hamilton LD, Sharples AP, Morton JP. Postexercise high-fat feeding suppresses p70S6K1 activity in human skeletal muscle. Med Sci Sport Exerc. 2016;48:2108–17.
- Stellingwerff T, Spriet LL, Watt MJ, Kimber NE, Hargreaves M, Hawley JA, Burke LM. Decreased PDH activation and glycogenolysis during exercise following fat adaptation with carbohydrate restoration. Am J Physiol Endocrinol Metab. 2006;290:380–8.
- Burke LM, Ross ML, Garvican-Lewis LA, Welvaert M, Heikura IA, Forbes SG, Mirtschin JG, Cato LE, Strobel N, Sharma AP, Hawley JA. Low carbohydrate, high fat diet impairs exercise economy and negates the performance benefit from intensified training in elite race walkers. J Physiol. 2017;595:2785–807.
- Stephens FB, Chee C, Wall BT, Murton AJ, Shannon CE, van Loon LJ, Tsintzas K. Lipid-induced insulin resistance is associ- ated with an impaired skeletal muscle protein synthetic response to amino acid ingestion in healthy young men. Diabetes. 2015;64:1615–20.
- Vogt S, Heinrich L, Schumacher YO, Grosshauser M, Blum A, Ko¨ nig D, Berg A, Schmid A. Energy intake and energy expen- diture of elite cyclists during preseason training. Int J Sports Med. 2005;26:701–6.
- Impey SG, Hammond KM, Shepherd SO, Sharples AP, Stewart C, Limb M, Smith K, Philp A, Jeromson S, Hamilton DL, Close GL, Morton JP. Fuel for the work required: a practical approach to amalgamating train-low paradigms for endurance athletes. Physiol Rep. 2016;4:e12803
- Lee-Young RS, Palmer MJ, Linden KC, LePlastrier K, Canny BJ, Hargreaves M, Wadley GD, Kemp BE, McConell GK. Carbo- hydrate ingestion does not alter skeletal muscle AMPK signalling during exercise in humans. Am J Physiol Endocrinol Metab. 2006;291:566–73.
- Ørtenblad N, Nielsen J, Saltin B, Holmberg H-C. Role of glycogen availability in sarcoplasmic reticulum Ca2? kinetics in human skeletal muscle. J Physiol. 2011;589:711–25.
- Duhamel TA, Perco JG, Green HJ. Manipulation of dietary car- bohydrates after prolonged effort modifies muscle sarcoplasmic reticulum responses in exercising males. Am J Physiol Regul Integr Comp Physiol. 2006;291:1100–10.
- Gejl KD, Hvid LG, Frandsen U, Jensen K, Sahlin K, Ørtenblad N. Muscle glycogen content modifies SR Ca2? release rate in elite endurance athletes. Med Sci Sports Exerc. 2014;46:496–505.
- Costa RJ, Jones GE, Lamb KL, Coleman R, Williams JH. The effects of a high carbohydrate diet on cortisol and salivary immunoglobulin A (s-IgA) during a period of increase exercise workload amongst Olympic and Ironman triathletes. Int J Sports Med. 2005;26:880–6.
- Jensen L, Gejl KD, Ørtenblad N, Nielsen JL, Bech RD, Nygaard T, Sahlin K, Frandsen U. Carbohydrate restricted recovery from long term endurance exercise does not affect gene responses involved in mitochondrial biogenesis in highly trained athletes. Physiol Rep. 2015;12:e121814.
- Gejl KD, Thams L, Hansen M, Rokkedal-Lausch T, Plomgaard P, Nybo L, Larsen FJ, Cardinale DA, Jensen K, Holmberg HC, Vissing K, Ørtenblad N. No superior adaptations to carbohydrate periodization in elite endurance athletes. Med Sci Sports Exerc. 2017;49(12):2486–97.
- Lane SC, Areta JL, Bird SR, Coffey VG, Burke LM, Desbrow B, Karagounis LG, Hawley JA. Caffeine ingestion and cycling power output in a low or normal muscle glycogen state. Med Sci Sports Exerc. 2013;45:1577–84.
- Gollnick PD, Piehl K, Saltin B. Selective glycogen depletion pattern in human skeletal muscle fibres after exercise of varying intensity and at varying pedalling rates. J Physiol. 1974; 241:45–57.
- De Bock K, Derave W, Ramaekers M, Richter EA, Hespel P. Fiber type-specific muscle glycogen sparing due to carbohydrate intake before and during exercise. J Appl Physiol. 2007;102 (1):183–8.




