
18 Jun Biología del VO2 max.: una Mirada desde la Perspectiva de la Fisiología
C. Lundby1, D. Montero 2 y M. Joyner 3
1 Zurich Centro de Fisiología Humana Integrativa, Instituto de Fisiología, Universidad de Zurich, Zurich, Suiza.
2 Departamento de Cardiología, Hospital Universitario Zurich, Zurich, Suiza.
3 Departamento de Anestesiología, Clínica Mayo, Rochester, MN, EE. UU.
Resumen
En esta revisión, argumentamos que diferentes características importantes del máximo consumo de oxígeno (VO2máx.) deberían servir de base para las discusiones sobre los determinantes biológicos y reduccionistas de su variabilidad interindividual: (i) los aumentos en el VO2máx. inducidos por el entrenamiento se ven facilitados en gran medida por un aumento en el volumen de glóbulos rojos y por una mejora asociada en el volumen sistólico, que también se adapta independientemente de los cambios experimentados en el volumen de glóbulos rojos. Estos conceptos generales también fueron observados en estudios transversales realizados en atletas que tenían valores muy altos de VO2máx. Por lo tanto, (ii) las variaciones en las mejoras del VO2máx. producidas por el entrenamiento físico probablemente también se relacionen con variaciones en estos determinantes fisiológicos. (iii) Todos los individuos sin entrenamiento previo responderán al entrenamiento de resistencia en términos de mejoras en VO2máx, siempre y cuando el estímulo exceda cierto volumen y/o intensidad. Por lo tanto, los estudios con análisis genéticos y/o los estudios reduccionistas que se realicen para comprender o predecir tales variaciones deberían centrarse específicamente en las variaciones del ADN o en otros fenómenos moleculares de relevancia para estas vías fisiológicas.
Palabras claves: ejercicio, genética, mitocondrias, no respondedores, rendimiento, volumen de glóbulos rojos.
Fisiología, Reduccionismo y Farolas
El consumo de oxígeno máximo (VO2máx) y su estrechamente relacionada correlación clínica la aptitud cardiorrespiratoria son determinantes fundamentales tanto en el rendimiento de deportes de resistencia de élite como de la mortalidad en la población general (Pedersen y Saltin 2015). En esta revisión, describiremos las vías fisiológicas dominantes y deterministas que explican la gran mayoría de la variabilidad interindividual en el VO2máx ampliamente conocidas y que se centran en el contenido total de hemoglobina corporal y volumen sistólico máximo, y como consecuencia en el gasto cardíaco. En este contexto, la búsqueda de explicaciones reduccionistas y de factores biológicos más básicos que podrían contribuir con la variabilidad interindividual en el VO2max y su respuesta al entrenamiento, debería centrarse en estas rutas fisiológicas. Adaptamos la “parábola de la farola” para resaltar nuestra posición. En la parábola de la farola, un individuo alcoholizado busca unas llaves que ha extraviado debajo de una farola porque ahí es donde “está la luz”. En la mayoría de los casos, la parábola de la farola es una advertencia sobre el sesgo observacional. Por el contrario, en el caso de VO2máx., la incapacidad de enfocarse debajo de la iluminación fisiológica ha conducido a una limitada visión sobre cualquier variación de ADN y sobre otros mecanismos moleculares que podrían contribuir con este fenotipo fisiológico crítico. Además, esperamos usar esta “iluminación fisiológica” para discutir dos tipos de estudios que buscan desentrañar cuales son los mecanismos biológicos básicos que sustentan el VO2máx. Un tipo de estudio son los estudios transversales realizados con atletas de élite que presentan fenotipos decididamente extremos debido a que poseen alguna dotación biológica además de los años de entrenamiento prolongado y de alta intensidad. El otro tipo de estudio es la clásica intervención a corto plazo que se realiza con ciudadanos ‘promedio’ que busca comprender los cambios fenotípicos asociados con períodos de ejercicio de pocos meses de duración.
La Masa de los Glóbulos Rojos, Hemoglobina Corporal Total, Volumen Sanguíneo y Volumen Sistólico Explican las Diferencias Interindividuales en el VO2 máx.
La Figura 1 muestra la clara relación entre el VO2máx expresado en L.min-1, el gasto cardíaco (L) y la masa de glóbulos rojos (mL). Además, las maniobras de intervención agudas que alteran estas variables también suelen alterar el VO2máx de forma Galbet et al. 2006b) consistente con estos datos transversales. Los puntos claves de la Figura 1, y comenzamos nuestra revisión con ellos, son las vías fisiológicas que regulan los determinantes del VO2max que son bien conocidas y en un contexto estadístico explican una fracción muy alta de la varianza poblacional. La claridad de estas relaciones fisiológicas tiene un marcado contraste con los estudios sobre cohortes más grandes de atletas de resistencia de élite que no encontraron una explicación genética clara para estos hallazgos (Rankinen et al.2016). Por el contrario, el esquiador de campo traviesa finlandés Eero Antero Mäntyranta (Olimpíadas de Invierno 1960–1972; ganador de siete medallas en tres de estas olimpíadas) tenía una variante en el receptor de eritropoyetina que le permitía aumentar la producción de glóbulos rojos y producía un nivel muy alto de hemoglobina corporal total y un alto VO2máx que, junto con un alto volumen de entrenamiento y talento para el deporte, le permitieron obtener sus asombrosos resultados. En este contexto, parece razonable proponer que cualquier búsqueda reduccionista de factores que expliquen la variabilidad interindividual en el VO2max y en cómo este responde frente al entrenamiento u otras condiciones, probablemente tendrá relación con estas importantes vías fisiológicas.
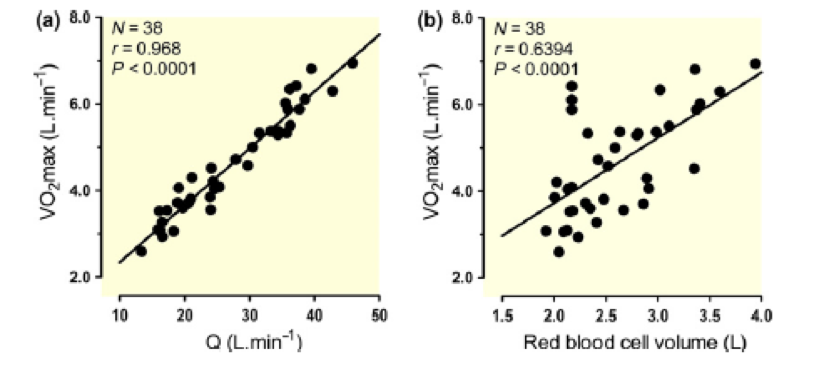
Figura 1. Correlación entre el VO2max, el gasto cardíaco máximo (a) y el volumen de glóbulos rojos (b). Algunos de estos conjuntos de datos fueron publicados previamente (Lundby y Robach 2015, Montero et al. 2015a). Todos los datos fueron obtenidos en el ‘laboratorio Lundby’ a través de CO (volumen de glóbulos rojos) y reinhalación de gas inerte (gasto cardíaco).
Adaptaciones Fisiológicas Fundamentales para Mejorar el VO2 máx.
El ejercicio regular, particularmente el entrenamiento de resistencia (ET), está asociado con múltiples modificaciones fenotípicas que pueden influir en el VO2máx (Hawley et al. 2014, Hellsten y Nyberg 2015). Estas están convencionalmente sistematizadas en dos categorías más amplias de acuerdo al rol que cumplen en el transporte de oxígeno (O2) o en la cadena de utilización del O2: mejora de la entrega convectiva de O2 o de la remoción del O2. La primera comprende principalmente un incremento en volumen de sangre (BV), en la capacidad de transporte de O2 de la sangre y en el gasto cardíaco; la última generalmente incluye adaptaciones del músculo esquelético tales como un aumento en la capitalización y en la cantidad de mitocondrias (Kjellberg et al. 1949a, Hoppeler y Weibel 1998). Se planteó la teoría que las adaptaciones relacionadas con el reclutamiento motor muscular regularían el VO2max pero esto ha sido refutado (Brink-Elfegoun et al. 2007, Hawkins y col. 2007); por lo tanto, no son abordadas en esta revisión, que de hecho se alinea con y amplía la visión “clásica” de que el VO2max estaría limitado principalmente por la capacidad circulatoria para entregar O2 al músculo que está realizando trabajo (Hill y Lupton 1923, Bassett & Howley 1997, Levine 2008). Sugerimos a los lectores consultar una revisión exhaustiva realizada por Levine (Levine 2008) y los debates recientes que discuten las teorías y los hechos sobre la limitación del VO2max (Lundby y Montero 2015, Wagner 2015).
Poder establecer los roles relativos de las adaptaciones al entrenamiento para determinar las mejoras en el VO2max es un tema fundamental en fisiología del ejercicio lo que a su vez tiene un impacto tangible en la prescripción de ejercicio enfocada en la aptitud cardiorrespiratoria (Mezzani y Guazzi 2016). A continuación les presentamos una integración de estudios que analizaron los efectos del ET sobre los posibles determinantes del VO2max y su impacto en el VO2max de sujetos no entrenados pero saludables. Hace casi medio siglo, los cuestionamientos se centraban alrededor de si el aumento en el VO2max luego del ET estaba sustentado por adaptaciones de naturaleza ‘central’ y/o ‘periférica’; respectivamente y principalmente reflejadas en los dos componentes de la ecuación de Fick (Figura 2): gasto cardíaco máximo (Qmax) y diferencia arterio-venosa de O2 (dif. a-vO2 ) (Ekblom et al. 1968, Saltin et al. 1968). Estos primeros estudios observaron un aumento en el Qmax solo o junto con un aumento en la diferencia arterio-venosa de O2 luego de 16 semanas de ET en un pequeño grupo de individuos jóvenes (<10) saludables (Ekblom et al. 1968, Saltin et al. 1968). Los estudios posteriores también fueron realizados con muestras de pequeño tamaño pero confirmaron los aumentos prevalentes en Qmax y dif. a-vO2 variables en respuesta a diversas intervenciones de ET que iban de cinco a 52 semanas de duración, principalmente individuos no entrenados de todas las edades (Klausen et al. 1982, Haennel et al. 1989, Ehsani et al. 1991, Spina et al. 1992, 1993a, b, 1998, Hijazi et al. 1998, Beere et al. , 1999, Marshall et al. 2001, Morris et al. 2002, Helgerud y col. 2007, Fujimoto et al. 2010, Murias et al. 2010a, b, Macpherson et al. 2011, Jacobs et al. 2013, Weng et al. 2013, Bonne et al. 2014, Wang et al. 2014). En conjunto, la evidencia sugiere que con intervenciones de entrenamiento con una duración ≥12 semanas, los efectos sobre la dif a-vO2 se hacen evidentes (Montero y Díaz-Cañestro, 2016, Montero et al. 2015b). Es importante destacar que estos meta-análisis revelan una relación lineal entre el VO2max y Qmax pero sin incrementos en la dif. a-vO2 (Montero y Díaz-Cañestro, 2016, Montero et al. 2015b). Esto destaca la dependencia predominante de cualquier mejora en el VO2max inducida por el ET en Qmax, lo que concuerda con la observación clásica de que el VO2max está básicamente determinado por la capacidad del sistema cardiovascular para entregar O2 (Taylor et al. 1955, Levine 2008).
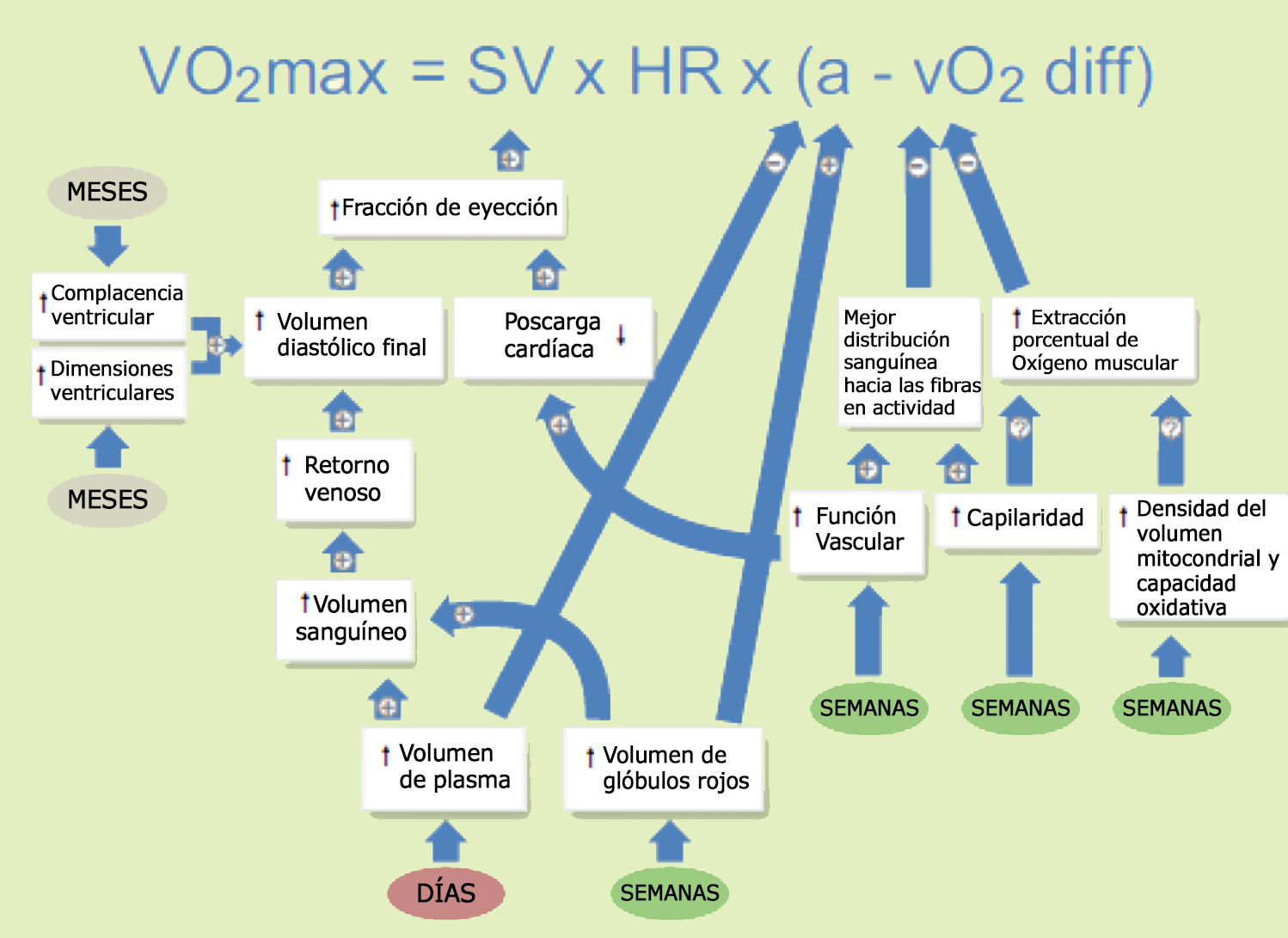
Figura 2. Adaptaciones fisiológicas que sustentan las mejoras en el consumo máximo de oxígeno (VO2 máx.) que se producen con el entrenamiento físico. La expansión del volumen plasmático se observa en las horas posteriores al ejercicio de todo el cuerpo y se mantiene elevada con el ejercicio regular (Bonne et al. 2014, Convertino 2007, Helgerud et al. 2007, Montero et al., 2015a, Sawka et al. 2000, Warburton y col. 2004). Se producen aumentos en el volumen de glóbulos rojos y en la capacidad total de transporte de oxígeno después de algunas semanas de entrenamiento (Bonne et al. 2014, Montero et al., 2015a). El aumento resultante del volumen sanguíneo facilita el retorno venoso que conduce a mayor volumen diastólico final y volumen sistólico (SV) a través del mecanismo Frank-Starling (Kanstrup y Ekblom 1982, Coyle et al. 1986, Hopper et al. 1988, Convertino et al. 1991). Los cambios en el volumen de plasma y en el volumen de glóbulos rojos también afectarán la diferencia a-vO2. Meses de entrenamiento pueden producir hipertrofia excéntrica cardíaca, una mejora moderada en la complacencia ventricular y una menor poscarga, y posiblemente producirían un mayor volumen diastólico final (Levine et al. 1991, Fleg et al. 1994, Spence et al. 2011). La frecuencia cardíaca máxima (FC) generalmente no se ve afectada por el entrenamiento físico. Entre las adaptaciones del músculo esquelético que podrían favorecer la extracción de O2 y, por lo tanto, la diferencia arteriovenosa de oxígeno (dif a-vO2), se incluyen principalmente los aumentos en el volumen/densidad mitocondrial, en la capacidad oxidativa y en la capilarización. Estos se notan claramente en las primeras semanas de entrenamiento, pero no tienen influencia en la dif a-vO2 (Montero et al., 2015a), lo que probablemente puede ser atribuible a la doble reserva funcional en la extracción de O2 muscular en el VO2max en el estado no entrenado (Calbet et al. 2015). La mejor dif a-vO2 se hace evidente después de aprox. 12 semanas de entrenamiento (Beere et al. 1999, Montero y Díaz-Cañestro, 2016, Montero et al. , 2015a). Esto podría deberse a una mejora en la distribución del flujo sanguíneo determinada principalmente por adaptaciones combinadas en la función dilatación/constricción de los vasos y en la estructura microvascular (Emerson & Segal 1997, Calbet et al. 2006a, Lundby et al. 2008). En última instancia, hay poco “margen” para aumentar la dif a-vO2y, por lo tanto, las mejoras en el VO2máx estarán determinadas esencialmente por los aumentos en el volumen sistólico (SV) junto con una capacidad de transporte de oxígeno relativamente preservada de la sangre.
Teniendo en cuenta la ecuación de Fick, el primer punto que debemos analizar es determinar cuáles adaptaciones explican los aumentos en Qmax inducidos por el entrenamiento y cómo estas contribuyen específicamente con el VO2max. Esto se puede observar en la Figura 2. En este sentido, los estudios experimentales han demostrado que los aumentos en Qmax y VO2maxdespués de 6 semanas de ET se revierten a los niveles pre-entrenamiento después anular las ganancias inducidas por el entrenamiento en el volumen sanguíneo (BV) mediante flebotomía (Bonne et al. 2014, Montero et al. 2015a). Esto sugiere fuertemente que los aumentos tempranos en Qmax y VO2max dependen exclusivamente del BV. Un mayor BV aumenta el gradiente de presión desde el depósito venoso central hacia la aurícula derecha lo que produce mejores retorno venoso, precarga cardíaca y volumen sistólico a través del mecanismo de Frank-Starling (Kanstrup & Ekblom 1982, Coyle et al. 1986, Hopper et al. 1988, Convertino et al. 1991). Es importante señalar que cualquier aumento en Qmax mediado por BV tiene poca influencia en la entrega de O2 y por lo tanto en el VO2max si solo se incrementa el volumen de plasma (PV), y no se incrementa también el volumen total de glóbulos rojos (RBCV), porque la capacidad de transporte de O2 de la sangre disminuye (Warburton et al. 2000, Keizer y col. 2015, Montero et al. 2015a). La expansión del BV inducida por el ET generalmente representa aproximadamente un 10% de incremento en el volumen de plasma (PV) luego de una sola serie de ejercicios y después de aprox. 2 semanas, junto con aumentos similares o menores en RBCV observados después de seis a 12 semanas (Sawka et al. 2000, Warburton et al. 2004, Convertino 2007, Helgerud et al. 2007, Bonne et al. 2014, Montero et al. 2015a). Se ha observado que con el entrenamiento de resistencia (ET) a largo plazo, el PV, RBCV y la masa absoluta de hemoglobina experimentan aumentos sustanciales (hasta 40%) en atletas de resistencia (Dill et al. 1974, Brotherhood et al. 1975, Heinicke et al. 2001, Lundby y Robach 2015). En estos atletas, la donación de 1 unidad de sangre (450 ml) provoca inmediatamente una disminución del 8% en el VO2máx, el cual no se reestablece después de 1 semana (Panebianco et al. 1995).
Los atletas de resistencia también presentan hipertrofia cardíaca excéntrica, una distensibilidad del ventrículo izquierdo ampliamente aumentada y una menor resistencia vascular periférica total (es decir, una disminución en la post carga), lo que en conjunto podría facilitar un mayor volumen sistólico (Levine et al. 1991, Fleg et al. 1994, Spence et al. 2011). Adaptaciones cardíacas similares pero de menor magnitud se observaron después de seis a 12 meses de ET en individuos previamente no entrenados, pero su contribución independiente con el Qmax no ha sido establecida experimentalmente (Spence et al. 2011, Arbab-Zadeh et al. 2014). Posiblemente las adaptaciones cardíacas pueden ser parcialmente la consecuencia de la elevación crónica del BV y de la presión venosa central (CVP) (Convertino et al. 1991), independientemente de los efectos directos del ET; en conjunto, podemos concluir sin temor a equivocarnos que los aumentos en BV junto con la capacidad total de transporte de oxígeno, caracterizada esencialmente por la expansión del volumen de glóbulos rojos (RBCV), son fundamentales para aumentar el VO2max.
A pesar de la influencia preponderante del RBCV en VO2max, existe cierta incertidumbre con respecto a los mecanismos estimulantes de la eritropoyesis que se desencadenan con el ET. El ejercicio agudo (normóxico) activa transitoriamente el factor-2α inducible por hipoxia y la liberación de eritropoyetina (EPO) en el musculo esquelético que realiza contracción (Lundby et al.2006a, Rundqvist y col. 2009). La concentración plasmática de EPO parece no verse afectada hasta 48 h después de 60 min de ejercicios que involucran todo el cuerpo (correr, andar en bicicleta) (Schmidt et al. 1991, Bodary et al. 1999). Por el contrario, se han observado incrementos de hasta ~ 100% en los niveles circulantes de EPO inmediatamente (Robach et al. 2014) (Schwandt et al. 1991) y 2-3 días después (Schwandt et al. 1991, Roecker y col. 2006, Robach et al. 2014) de realizar ejercicio extenuante de larga duración [(ultra) maratón], aunque esto es no es un hallazgo universal (Weight et al. 1992). Estas observaciones podrían confundirse con cambios simultáneos en el volumen de plasma (PV). Además, se ha propuesto que el rápido aumento de PV en los primeros días del ET podría impulsar al sistema eritropoyético para alcanzar un nuevo equilibrio en el hematocrito que regrese parcialmente a los niveles previos al entrenamiento (Sawka et al. 2000, Schmidt y Prommer 2008, Jelkmann y Lundby 2011). Sin embargo, no hay pruebas de que un PV incrementado per se pueda estimular la síntesis de eritropoyetina (EPO) en condiciones de un RBCV normal. Además, la observación de incrementos ligeramente mayores en RBCV que en PV después de 6 semanas de ET sugiere que la expansión del RBCV podría estar, al menos en parte, no regulada finalmente por el PV (Montero et al. , 2015a).
Alternativamente a las señales relacionadas con la hipoxia, el nivel de llenado (y/o la distribución del volumen de sangre en) el sistema cardiovascular, tal como lo refleja la presión venosa central (CVP), se reduce notablemente durante varias horas después de ejercicios para todo el cuerpo (Kirsch et al. 1975, 1986). Esto es detectado por los receptores de estiramiento de volumen auricular y centrales que estimulan la secreción de hormonas reguladoras del volumen sanguíneo (BV) y posiblemente desencadenen una respuesta eritropoyética (Montero et al.2016). Cuando la CVP disminuye agudamente por inclinación en todo el cuerpo, se incrementa la concentración de EPO, un efecto mediado por aumentos concomitantes en vasopresina, que puede mejorar la secreción de EPO a través de la activación de los receptores V1a (Engel & Pagel 1995, Montero et al. 2016). Por lo tanto, la eritropoyesis inducida por ET podría regularse independientemente por un circuito de retroalimentación endocrina paralelo al que regula la PV y la homoeostasis del líquido intersticial. Además, el ET mejora el microambiente hematopoyético y altera el patrón de secreción de catecolaminas, péptidos (hormona del crecimiento, factores de crecimiento similares a la insulina) y hormonas esteroides (testosterona, cortisol), que pueden influir en la producción y/o en la liberación de la médula ósea de glóbulos rojos (Hu y Lin 2012). La importancia relativa de los mecanismos anteriores en la respuesta eritropoyética frente al ET no ha sido establecida detalladamente y sigue siendo un gran desafío para poder comprender las bases fisiológicas del acondicionamiento aeróbico. Es importante destacar que aún no se han identificado las variantes comunes en los patrones genéticos que podrían modular las rutas fisiológicas que controlan el suministro de O2 convectivo (Sarzynski et al.2016). Sin embargo, al menos un informe de casos sobre la presencia de una variante rara en un campeón; un atleta que tenía un RBCV muy alto refuerza el punto crucial planteado aquí (Thompson 2012).
La contribución de las adaptaciones asociadas con las adaptaciones periféricas y la extracción de O2 asociada a las mejoras de VO2max merecen atención. Como mencionamos anteriormente, la dif. a-vO2 aumenta principalmente con el ET a largo plazo, aunque modificaciones fenotípicas consideradas típicamente para mejorar la extracción de O2 emergen en las primeras etapas del ET (Montero et al. , 2015a). Aquí, se observan grandes incrementos en la capilarización del músculo esquelético (18%) y la densidad del volumen mitocondrial (43%) después de 6 semanas de ET, pero la dif. a-vO2 no se altera (Montero et al. , 2015a). En concordancia con esto, no se observaron mejoras en el VO2max luego de 4–7 semanas de ET realizado con una sola pierna cuando Qmax no aumenta, aún cuando la extracción máxima de O2 aumenta en la pierna entrenada en comparación a la pierna considerada como control (Gleser 1973, Rud et al. 2012). De hecho, la extracción de O2 muscular no es máxima en el VO2máx y estudios experimentales recientes demuestran una reserva funcionalidad dos veces mayor en individuos no entrenados (Calbet et al. 2015).
Una serie inteligente de experimentos realizados con ratas nos proporciona más información sobre esta cuestión fundamental. Davies y colegas (Davies et al. 1982) realizaron un estudio con animales anémicos que poseían deficiencias de hierro y no tenían un funcionamiento mitocondrial normal en sus músculos esqueléticos. Estos animales tenían valores inferiores de VO2max y menores tiempos de resistencia. La corrección aguda de la anemia normalizó sus valores de VO2max pero tuvo poco impacto en el tiempo de resistencia. Este modelo confirma la primacía del transporte convectivo de O2 como el principal determinante del VO2max. En paralelo con estas observaciones están las observaciones que en individuos que han estado entrenando durante muchos años, las adaptaciones mitocondriales son uniformemente altas pero están disociadas del VO2max (Lundby y Jacobs 2016). En esta línea, en humanos sanos, la capacidad oxidativa mitocondrial excede la del suministro de O2 en el VO2máx y por lo tanto, actualmente no se considera que limite la extracción de O2 (Boushel et al. 2011, Lundby y Montero 2015). En conjunto, en el musculo, las adaptaciones que mejoran la extracción máxima de O2 pueden, por lo tanto, no ser fundamentales para aumentar la dif. a-vO2 y, consecuentemente el VO2max. En contraste con nuestras conclusiones, existen puntos de vista opuestos basados principalmente en modelos teóricos (Wagner 1992, 2015, Lundby y Montero 2015).
La extracción de O2 (según lo medido) y la dif. a-vO2 pueden ser funciones de la distribución del flujo sanguíneo entre fibras musculares activas/inactivas y otros tejidos en distintos niveles (todo el cuerpo, extremidades, músculos) (Kalliokoski et al. 2001, 2005, Calbet et al. 2006a). La distribución de la circulación sanguínea (BFD) durante el ejercicio está posiblemente determinada por la interacción de la función vascular dilatadora/constrictora, la regulación simpática y la estructura microvascular (Emerson y Segal 1997, Calbet et al. 2006a, Lundby y col. 2008, Joyner y Casey 2015). Un cambio en la BFD podría explicar la observación de que algunos individuos no presentan cambios en la dif. a-vO2 de las piernas pero experimentan un aumento en la dif. a-vO2 de todo el cuerpo después de 12 semanas de ET en bicicleta ergométrica (Beere et al. 1999). Además, se observó un aumento en la BFD y un incremento en la dif. a-vO2 en el musculo de la pierna que se encuentra realizando ejercicio (cuádriceps femoral) durante ejercicios submáximos en individuos crónicamente entrenados (Kalliokoski et al. 2001). Independientemente, el hecho de que la dif. a-vO2 se encuentre cerca de los niveles máximos en el agotamiento en individuos no entrenados y entrenados, evita un impacto importante en el VO2max de cualquier mejora potencial en BFD durante el ejercicio (sub) máximo (Lundby et al. 2006b, Rud et al. 2012).
Sujetos no Respondedores al Entrenamiento Físico: Inconvenientes que Encontramos
En los últimos años, se ha prestado mucha atención a un concepto emergente que algunas personas aparentemente no responden al entrenamiento de resistencia con una marcada mejora en el VO2máx. Por lo tanto han sido llamados no respondedores. Considerando los inmensos beneficios para la salud asociados con la aptitud cardiorrespiratoria y las mejoras en el VO2máx y la relación general entre aptitud física y mortalidad por todas las causas, es posible que tales hallazgos puedan llevar a ciertas personas a abstenerse de realizar ejercicio debido a beneficios inciertos e incluso a causa de lo que algunos han llamado respuestas adversas al entrenamiento para ciertos factores de riesgo (Bouchard et al. 2012). En este contexto, también nos preocupa que las evidencias científicas subyacentes del fenómeno de no respondedor tengan limitaciones que hayan sido subestimadas y que es poco probable que una búsqueda hipotéticamente neutra de variantes de ADN que determinen las respuestas al entrenamiento nos permita obtener explicaciones que puedan ser conciliadas con principios fisiológicos conocidos relacionados al transporte de oxígeno y al intercambio de gases que describimos más arriba. También nos preocupa que el concepto de no respondedor no permita reconocer los efectos protectores del ejercicio que van más allá de los cambios en los factores de riesgo tradicionales asociados con un estado de entrenamiento de resistencia (Joyner & Green 2009).
¿Cómo se Originó el Concepto de no Respondedor?
El término no respondedores fue acuñado en base a datos obtenidos en Heritage Family Study (Estudio de Herencia Familia). En este estudio histórico, 483 individuos sedentarios que integraban grupos familiares realizaron 20 semanas de entrenamiento físico tres veces a la semana. Inicialmente, se entrenaron durante 30 minutos con una frecuencia cardíaca correspondiente al 55% de su VO2máx, pero cada 2 semanas, la intensidad y la duración se incrementaron progresivamente hasta que realizaron 50 min de ejercicio al 75% de VO2máx. Esto se logró en la semana de entrenamiento 14. El espectro de mejoras en VO2max varió desde cero a más de 1 L de O2/min (Skinner et al. 2001, Bouchard et al. 2011). El análisis retrospectivo subsiguiente sugirió que hasta el 49% de la variación en la respuesta al entrenamiento podría ser atribuida a herencia basada en la presencia o ausencia acumulativa de 21 polimorfismos de un solo nucleótido. Sin embargo, estos resultados se basan en procedimientos de regresiones por pasos que han sido ampliamente desacreditados en la literatura y, por lo tanto, deben ser interpretados con precaución (Mundry y Nunn 2009). Además, la cantidad de variantes genéticas que podrían estar asociadas con un aumento en VO2max se ha incrementado y para el año 2009 ‘ El mapa genético humano de los fenotipos de aptitud física asociados al rendimiento y la salud ya contemplaba la existencia de 239 genes (Bray et al. 2009). Sin embargo, la mayoría de estas variantes o vías no están claramente vinculadas a los sistemas fisiológicos responsables del transporte masivo de oxígeno desde el aire hacia los tejidos que regulan los determinantes fisiológicos de VO2max y casi todos tienen efectos de muy pequeño tamaño. En este contexto, los autores del estudio de herencia (Heritage Study) reconocieron que los estudios de genes candidatos y de asociación genómica amplia no han podido contribuir claramente con nuestra comprensión de cuál es la base molecular de las variaciones en las adaptaciones al ejercicio (Sarzynski et al.2016). Es importante destacar que las variantes del gen de la enzima convertidora de angiotensina que alguna vez se pensó que estaba asociada con niveles muy altos de VO2máx no fueron confirmadas en un estudio realizado con una gran muestra de atletas de resistencia de élite (Rankinen et al. 2000). Destacamos este hallazgo porque demuestra que incluso para un gen que podría desempeñar un papel plausible en la regulación del volumen sanguíneo y/o en la hipertrofia cardíaca, es difícil obtener un panorama claro entre las variantes del ADN y el VO2max.
Un hallazgo a menudo ignorado o pasado por alto del estudio de Herencia es que la intensidad del ejercicio fue controlada automáticamente con monitores de la frecuencia cardíaca. Esto podría haber provocado que las cargas de trabajo del entrenamiento hayan disminuido gradualmente en el transcurso de una sesión de entrenamiento porque la frecuencia cardíaca se eleva hacia arriba con el ejercicio continuo. De hecho, se produjeron fluctuaciones en la carga de trabajo del entrenamiento y explicaron en parte la respuesta al entrenamiento (Sarzynski et al. 2016). Aunque no se informó específicamente, los no respondedores podrían ser razonablemente aquellas personas que tienen el mayor desajuste entre las cargas de trabajo fijadas y las alcanzadas, lo que plantearía la pregunta obvia: ¿Los que no respondieron; simplemente no respondieron al régimen de entrenamiento porque la intensidad y/o el volumen fueron ¿demasiado bajos?. Además debemos tener en cuenta que estudios más pequeños realizados en una serie de cohortes, entre las que se incluían gemelos idénticos (Prud’homme et al. 1984), observaron cambios altamente variables en el VO2max en respuesta a un entrenamiento similar al entrenamiento para adultos descripto más arriba para el estudio de Herencia. Finalmente, aunque resulta fácil criticar el estudio de Herencia en retrospectiva, debemos recordar que en el momento en que fue realizado fue un estudio absolutamente innovador y requirió un grado de coordinación y un nivel intelectual verdaderamente impresionante para diseñarlo y ejecutarlo y también incluía mujeres junto con varios grupos raciales y rangos de edad. Que no haya surgido un patrón claro de variantes de ADN para explicar un alto porcentaje de los resultados observados en el estudio de herencia probablemente representa una limitación que surgió posteriormente en lo que se denominó la hipótesis de la “variante común “ que fue ampliamente anticipada en el momento en que se concibió el estudio (Weiss 2008, Shields 2011).
¿Todos los Individuos sin Entrenamiento previo Obtendrán Beneficios a partir del Entrenamiento Físico si se Esfuerzan lo Suficiente?
A principios del siglo pasado (i.e., 1900), se sugirió que el entrenamiento físico facilita el VO2máx en humanos y que tanto el volumen como la intensidad pueden influir en los resultados del mismo. Poco después y sobre la base de experiencias obtenidas en atletas y entrenadores, se incorporaron las repeticiones de alta intensidad, fartlek y entrenamiento intervalado y revolucionaron el rendimiento en running. Dos de los atletas más notables que utilizaron estos enfoques en sus regímenes de entrenamiento fueron Roger Bannister (primera persona en marcar la milla en menos de 4:00 min) y Emil Zatopek (múltiple campeón olímpico). Algunos de los primeros estudios científicos realizados con atletas que utilizaron entrenamiento de alta intensidad demostraron que incluso con volúmenes modestos de entrenamiento de alta intensidad, podían alcanzarse valores muy altos de VO2máx(Robinson et al. 1937). Además, los primeros trabajos de varios laboratorios aportaron evidencia de que estos valores altos de VO2máx se asociaban con volúmenes sistólicos muy grandes y muy altos valores de hemoglobina corporal total (Kjellberg et al. 1949a, b).
Desde entonces, una gran cantidad de estudios científicos han demostrado que el entrenamiento intervalado es efectivo para aumentar el VO2máx. Por ejemplo, después de 2 meses de entrenamiento intervalado de alta intensidad (15 s de carrera máxima/15 s de descanso al final con un total de 15 minutos de ejercicio de alta intensidad o 3 minutos de carrera máxima/3 minutos de descanso, nuevamente realizados de modo que el tiempo total de ejercicio de alta intensidad sea = 15 min) realizado tres veces por semana (es decir, igual que en el estudio de herencia) “todos los sujetos (n=37) presentaron incrementos demostrados en esta capacidad funcional (VO2máx)” (Figs. 2 y 3 en el estudio de Knuttgen y col. (1973)). Posteriormente, Hickson y colegas (Hickson et al. 1977) observaron que un período de intervención de entrenamiento de diez semanas donde se alternaban carreras diarias (seis por semana) intervaladas (5 x 5 min a VO2máx) y continuas (lo más rápido posible durante 30–40 min) produjo mejoras en el VO2máx de al menos 700 ml de O2 min-1 en todos (n=8) los participantes. Estos regímenes de entrenamiento son obviamente de naturaleza mucho más rigurosa que los aplicados en el Estudio de Herencia Familiar (Heritage Family Study), y uno aplicando sabiduría popular podría tener la tentación de concluir “No hay frutos sin esfuerzo”. Sin embargo, también podemos argumentar que no muchos individuos, y sobre todo los individuos no entrenados, estarían dispuestos a soportar tales entrenamientos. Los estudios, sin embargo, sugieren que con el entrenamiento adecuado, no existen los no respondedores al entrenamiento físico. Un apoyo adicional surge de un reciente meta análisis (Bacon et al. 2013) que reveló que el entrenamiento intervalado/alta intensidad producía una mejora en VO2máx ligeramente mayor a la observada típicamente con el “entrenamiento continuo basado en la aptitud física para adultos” a pesar de que muchos de los estudios con entrenamiento intervalado eran estudios de duración más corta y con una menor cantidad de sesiones de entrenamiento por semana. Ross y colegas (Ross et al. 2015) realizaron un estudio altamente necesario que demostró la importancia del volumen y la intensidad del ejercicio para las mejoras en VO2máx. En ese estudio, 192 personas fueron asignadas a un grupo que realizó 24 semanas de entrenamiento que consistía en cinco sesiones por semana que incluía (A) 180/300 kcal (mujeres/varones) realizadas al 50% del VO2max, (B) 360/600 kcal realizadas a 50% del VO2max y (C) 360/600 kcal al 75%. En los grupos A y B, 38.5 y 17.6%, respectivamente, de los participantes fueron clasificados como no respondedores después de la intervención de entrenamiento, mientras que en el grupo C el número fue 0. Por lo tanto este estudio demostró que al duplicar el volumen de entrenamiento (grupo A vs. B), los no respondedores disminuyeron en un 50%, y si se agregaba más intensidad (grupo B vs. C), luego el fenómeno desaparece por completo. En función de lo observado en este estudio, se podría especular que si los participantes del Estudio de Herencia hubieran entrenado cinco sesiones por semana en lugar de tres, entonces quizás el resultado podría haber sido completamente diferente.
¿Cómo debería entrenar un sujeto para evitar ser catalogado como un no respondedor?. Nordesjö (Nordesjö 1974) observó mejoras similares en VO2 max (todos los participantes obtuvieron mejoras) entre grupos que corrieron (A) 15 min una vez por semana a una frecuencia cardíaca (FC) de 190 latidos/min, (B) 3 carreras de 60 min por semana a una FC de 150 o (C) 5 carreras de 120 min por semana a FC de 110. Por lo tanto, existe una compensación obvia entre intensidad y volumen, y parece probable que si la intensidad del entrenamiento hubiera sido mayor en el grupo de baja intensidad (Grupo A) del estudio de Ross (Ross et al. 2015) y también en el estudio de Herencia, entonces el índice de no respondedores sería mínimo o inexistente. Además hay una serie de observaciones anecdóticas (Astrand y Rodahl 1986) sobre varones jóvenes “promedio” quienes fueron sometidos a entrenamientos prolongados y de alta intensidad de nivel casi profesional y alcanzaron valores de VO2máximos de casi 60 ml kg-1min-1. Aunque este valor parece alto en una primera mirada, imaginemos un varón joven con un VO2máximo de 3,2 L min-1 y peso corporal de 80 kg. Tal individuo casi seguramente será capaz de aumentar su máximo a aproximadamente 4 L min-1 con varios años de entrenamiento. Si al mismo tiempo su peso corporal disminuye a 70 kg, su VO2máx sería igual 57 ml kg-1 min-1. De ninguna manera élite, sino un valor tal vez suficiente para correr un maratón en poco más de tres horas. Tales valores ciertamente no parecen inconcebibles sobre la base del estudio original de Hickson y colegas y de estudios más recientes de Howden y colegas (Howden et al. 2015). En el último estudio, sorprendentemente se demostró que las mujeres responden algo menos a una intervención de entrenamiento en comparación con los varones. El número muy pequeño de participantes en este estudio (siete hombres y cinco mujeres) plantea la necesidad de realizar más estudios sobre este tema que contemplen un mayor número de sujetos y la valoración concomitante de la masa de hemoglobina. Además, es muy importante determinar el nivel de hierro que tenían las mujeres que participaron en el estudio ya que mujeres que poseen ~ 20% pueden estar anémicas y, por lo tanto, probablemente menos propensas a aumentar sus masa de hemoglobina. Además, muchos de los datos en los que nos hemos centrado fueron obtenidos en estudios realizados en varones porque solo se estudió un número limitado de mujeres antes de la década de 1990 o 2000. Finalmente, se repetirá algún marcador genético asociado con las respuestas al entrenamiento físico de corto plazo en adultos en respuesta al entrenamiento de la resistencia de alta intensidad y larga duración?.
Conclusión y Perspectivas
Opinamos que existen datos abrumadores que demuestran que todos los humanos sin entrenamiento previo responderán a los regímenes de entrenamiento de resistencia siempre que el estímulo sea suficiente. En su mayoría estas mejoras se asocian con los aumentos observados en RBCV que se producen en un lapso de semanas, lo que permite una mayor capacidad de unión de O2, un mayor volumen sistólico y por lo tanto una mejor capacidad de transporte de O2. Sorprendentemente, no se conocen con detalle los mecanismos que producen el aumento del volumen de glóbulos rojos (RBCV) con el entrenamiento físico. Con meses de entrenamiento, el volumen sistólico también podría ser favorecido por el crecimiento cardíaco y por la complacencia ventricular moderadamente aumentada. Considerando que los factores que promueven el VO2max durante el entrenamiento de resistencia están limitados en gran medida por el aumento de RBCV y del volumen sistólico, podría tener sentido que aquellos estudios cuyo objetivo sea predecir o explicar los mecanismos biológicos responsables de variaciones en la entrenabilidad del VO2max deberán (i) usar un programa de entrenamiento diseñado para obtener el máximo aumento en VO2max en un individuo dado. Esto significa que sería necesario realizar entrenamiento prolongado y de alta intensidad y (ii) centrarse en las respuestas hormonales, variantes genéticas y adaptaciones moleculares de relevancia para las vías fisiológicas dominantes que hemos destacado en este documento. Desde una perspectiva evolutiva, cuando se encuentran variantes de ADN en poblaciones específicas (como los grupos que han estado expuestos a muchas generaciones a hipoxia profunda), existe evidencia sustancial de selección y surgen variantes relativamente comunes en vías fisiológicas clave (Simonson 2015). En este contexto, los valores estimados de VO2max para los varones recolectores cazadores están en el orden de 55–60 ml kg-1 min-1 (Joyner y Casey 2015). Dado que estos valores son similares a los alcanzados por la mayoría varones jóvenes activos delgados, nos preguntamos (en ausencia de un argumento claro y evidencia para la presión de selección), si sería posible identificar las variaciones de ADN fácilmente identificables en las vías fisiológicas clave para el VO2máx que hemos destacado tanto en individuos promedio como en atletas de resistencia de élite.
Cita Original
Lundby C., D. Montero and M. Joyner. Biology of VO2max: looking under the physiology lamp. (2017). Acta Physiol, 220, 218–228.
Referencias
- Arbab-Zadeh, A., Perhonen, M., Howden, E., Peshock, R.M., Zhang, R., Adams-Huet, B., Haykowsky, M.J. & Levine, B.D. 2014. Cardiac remodeling in response to 1 year of intensive endurance training. Circulation 130, 2152–2161.
- Astrand, P.O. & Rodahl, K. 1986. Chapter 10: physical training. In: D.B.V. Dalen, (ed) Textbook of Work Physiology, pp. 412–485. McGraw-Hill Book Company, Singapore.
- Bacon, A.P., Carter, R.E., Ogle, E.A. & Joyner, M.J. 2013. VO2max trainability and high intensity interval training in humans: a meta-analysis. PLoS ONE 8, e73182.
- Bassett, D.R. Jr & Howley, E.T. 1997. Maximal oxygen uptake: “classical” versus “contemporary” viewpoints. Med Sci Sports Exerc 29, 591–603.
- Beere, P.A., Russell, S.D., Morey, M.C., Kitzman, D.W. & Higginbotham, M.B. 1999. Aerobic exercise training can reverse age-related peripheral circulatory changes in healthy older men. Circulation 100, 1085–1094.
- Bodary, P.F., Pate, R.R., Wu, Q.F. & McMillan, G.S. 1999. Effects of acute exercise on plasma erythropoietin levels in trained runners. Med Sci Sports Exerc 31, 543–546.
- Bonne, T.C., Doucende, G., Fluck, D., Jacobs, R.A., Nordsborg, N.B., Robach, P., Walther, G. & Lundby, C. 2014. Phlebotomy eliminates the maximal cardiac output response to six weeks of exercise training. Am J Physiol Regul Integr Comp Physiol 306, R752–R760.
- Bouchard, C., Sarzynski, M.A., Rice, T.K., Kraus, W.E., Church, T.S., Sung, Y.J., Rao, D.C. & Rankinen, T. 2011. Genomic predictors of the maximal O2 uptake response to standardized exercise training programs. J Appl Physiol (1985) 110, 1160–1170.
- Bouchard, C., Blair, S.N., Church, T.S., Earnest, C.P., Hagberg, J.M., H€akkinen, K., Jenkins, N.T., Karavirta, L., Kraus, W.E., Leon, A.S., Rao, D.C., Sarzynski, M.A., Skinner, J.S., Slentz, C.A. & Rankinen, T. 2012. Adverse metabolic response to regular exercise: is it a rare or common occurrence? PLoS ONE 7, e37887.
- Boushel, R., Gnaiger, E., Calbet, J.A., Gonzalez-Alonso, J., Wright-Paradis, C., Sondergaard, H., Ara, I., Helge, J.W. & Saltin, B. 2011. Muscle mitochondrial capacity excedes maximal oxygen delivery in humans. Mitochondrion 11, 303–307.
- Bray, M.S., Hagberg, J.M., Perusse, L., Rankinen, T., Roth, S.M., Wolfarth, B. & Bouchard, C. 2009. The human gene map for performance and health-related fitness phenotypes: the 2006-2007 update. Med Sci Sports Med 41, 35–73.
- Brink-Elfegoun, T., Kaijser, L., Gustafsson, T. & Ekblom, B. 2007. Maximal oxygen uptake is not limited by a central nervous system governor. J Appl Physiol (1985), 102, 781–786.
- Brotherhood, J., Brozovic, B. & Pugh, L.G. 1975. Haematological status of middle- and long-distance runners. Clin Sci Mol Med 48, 139–145.
- Calbet, J.A., Lundby, C., Sander, M., Robach, P., Saltin, B. & Boushel, R. 2006a. Effects of ATP-induced leg vasodilation on VO2 peak and leg O2 extraction during maximal exercise in humans. Am J Physiol Regul Integr Comp Physiol 291, R447–R453.
- Calbet, J.A.L., Lundby, C., Koskolou, M. & Boushel, R. 2006b. Importance of hemoglobin concentration to exercise: acute manipulations. Respir Physiol Neurobiol 151, 132–140.
- Calbet, J.A., Losa-Reyna, J., Torres-Peralta, R., Rasmussen, P., Ponce-Gonzalez, J.G., Sheel, A.W., de la Calle-Herrero, J., Guadalupe-Grau, A., Morales-Alamo, D., Fuentes, T., Rodriguez-Garcia, L., Siebenmann, C., Boushel, R. & Lundby, C. 2015. Limitations to oxygen transport and utilization during sprint exercise in humans: evidence for a functional reserve in muscle O2 diffusing capacity. J Physiol 593, 4649–4664.
- Convertino, V.A. 2007. Blood volume response to physical activity and inactivity. Am J Med Sci 334, 72–79.
- Convertino, V.A., Mack, G.W. & Nadel, E.R. 1991. Elevated central venous pressure: a consequence of exercise traininginduced hypervolemia? Am J Physiol 260, R273–R277.
- Coyle, E.F., Hemmert, M.K. & Coggan, A.R. 1986. Effects of detraining on cardiovascular responses to
- exercise: role of blood volume. J Appl Physiol (1985) 60, 95–99.
- Davies, K.J., Maquire, J.J., Brooks, G.A., Dallman, P.R. & Packer, L. 1982. Muscle mitochondrial bioenergetics, oxygen supply, and work capacity during dietary iron deficiency and repletion. Am J Physiol 242, 418–427.
- Dill, D.B., Braithwaite, K., Adams, W.C. & Bernauer, E.M. 1974. Blood volume of middle-distance runners: effect of 2,300-m altitude and comparison with non-athletes. Med Sci Sports 6, 1–7.
- Ehsani, A.A., Ogawa, T., Miller, T.R., Spina, R.J. & Jilka, S.M. 1991. Exercise training improves left ventricular systolic function in older men. Circulation 83, 96–103.
- Ekblom, B., Astrand, P.O., Saltin, B., Stenberg, J. & Wallstrom, B. 1968. Effect of training on circulatory response to exercise. J Appl Physiol 24, 518–528.
- Emerson, G.G. & Segal, S.S. 1997. Alignment of microvascular units along skeletal muscle fibers of hamster retractor. J Appl Physiol (1985) 82, 42–48.
- Engel, A. & Pagel, H. 1995. Increased production of erythropoietin after application of antidiuretic hormone. A consequenceof renal vasoconstriction? Exp Clin Endocrinol Diabetes 103, 303–307.
- Fleg, J.L., Schulman, S.P., O’Connor, F.C., Gerstenblith, G., Becker, L.C., Fortney, S., Goldberg, A.P. & Lakatta, E.G. 1994. Cardiovascular responses to exhaustive upright cycle exercise in highly trained older men. J Appl Physiol (1985) 77, 1500–1506.
- Fujimoto, N., Prasad, A., Hastings, J.L., Arbab-Zadeh, A., Bhella, P.S., Shibata, S., Palmer, D. & Levine, B.D. 2010. Cardiovascular effects of 1 year of progressive and vigorous exercise training in previously sedentary individuals older than 65 years of age. Circulation 122, 1797– 1805.
- Gleser, M.A. 1973. Effects of hypoxia and physical training on hemodynamic adjustments to one-legged exercise. J Appl Physiol 34, 655–659.
- Haennel, R., Teo, K.K., Quinney, A. & Kappagoda, T. 1989. Effects of hydraulic circuit training on cardiovascular function. Med Sci Sports Exerc 21, 605–612.
- Hawkins, M.N., Raven, P.B., Snell, P.G., Stray-Gundersen, J. & Levine, B.D. 2007. Maximal oxygen uptake as a parametric measure of cardiorespiratory capacity. Med Sci Sports Exerc 39, 103–107.
- Hawley, J.A., Hargreaves, M., Joyner, M.J. & Zierath, J.R. 2014. Integrative biology of exercise. Cell 159, 738–749.
- Heinicke, K., Wolfarth, B., Winchenbach, P., Biermann, B.,Schmid, A., Huber, G., Friedmann, B. & Schmidt, W. 2001. Blood volume and hemoglobin mass in elite athletes of different disciplines. Int J Sports Med 22, 504–512.
- Helgerud, J., Hoydal, K., Wang, E., Karlsen, T., Berg, P., Bjerkaas, M., Simonsen, T., Helgesen, C., Hjorth, N., Bach, R. & Hoff, J. 2007. Aerobic high-intensity intervals improve VO2max more than moderate training. Med Sci Sports Exerc 39, 665–671.
- Hellsten, Y. & Nyberg, M. 2015. Cardiovascular adaptations to exercise training. Compr Physiol 6, 1–32.
- Hickson, R.C., Bomze, H.A. & Holloszy, J.O. 1977. Linear increase in aerobic power induced by a strenuous program of endurance exercise. J Appl Physiol 42, 372–376.
- Hijazi, O.M., Ramanathan, M., Estrera, A.S., Peshock, R.M. & Hsia, C.C. 1998. Fixed maximal stroke index in patients after pneumonectomy. Am J Respir Crit Care Med 157, 1623–1629.
- Hill, A.V. & Lupton, H. 1923. Muscular exercise, lactic acid, and the supply and utilization of oxygen. Q J Med Jan, 135–171.
- Hoppeler, H. & Weibel, E.R. 1998. Limits for oxygen and substrate transport in mammals. J Exp Biol 201, 1051–1064.
- Hopper, M.K., Coggan, A.R. & Coyle, E.F. 1988. Exercise stroke volume relative to plasma-volume expansion. J Appl Physiol (1985), 64, 404–408.
- Howden, E.J., Perhonen, M., Peshock, R.M., Zhang, R., Arbab-Zadeh, A., Adams-Huet, B. & Levine, B.D. 2015. Females have a blunted cardiovascular response to one year of intensive supervised endurance training. J Appl Physiol (1985) 119, 37–46.
- Hu, M. & Lin, W. 2012. Effects of exercise training on red blood cell production: implications for anemia. Acta Haematol 127, 156–164.
- Jacobs, R.A., Fluck, D., Bonne, T.C., Burgi, S., Christensen, P.M., Toigo, M. & Lundby, C. 2013. Improvements in exercise performance with high-intensity interval training coincide with an increase in skeletal muscle mitocondrial content and function. J Appl Physiol (1985) 115, 785–793.
- Jelkmann, W. & Lundby, C. 2011. Blood doping and its detection. Blood 118, 2395–2404.
- Joyner, M.J. & Casey, D.P. 2015. Regulation of increased blood flow (Hyperemia) to muscles during exercise: a hierarchy of competing physiological needs. Physiol Rev 95, 549–601.
- Joyner, M.J. & Green, D.J. 2009. Exercise protects the cardiovascular system: effects beyond traditional risk factors. J Physiol 587, 5551–5558.
- Kalliokoski, K.K., Oikonen, V., Takala, T.O., Sipila, H., Knuuti, J. & Nuutila, P. 2001. Enhanced oxygen extraction and reduced flow heterogeneity in exercising muscle in endurance-trained men. Am J Physiol Endocrinol Metab 280, E1015–E1021.
- Kalliokoski, K.K., Knuuti, J. & Nuutila, P. 2005. Relationship between muscle blood flow and oxygen uptake during exercise in endurance-trained and untrained men. J Appl Physiol (1985) 98, 380–383.
- Kanstrup, I.L. & Ekblom, B. 1982. Acute hypervolemia, cardiac performance, and aerobic power during exercise. J Appl Physiol Respir Environ Exerc Physiol 52, 1186–1191.
- Keiser, S., Fluck, D., Huppin, F., Stravs, A., Hilty, M.P. & Lundby, C. 2015. Heat training increases exercise capacity in hot but not in temperate conditions: a mechanistic counter- balanced cross-over study. Am J Physiol Heart Circ Physiol 309, H750–H761.
- Kirsch, K., Risch, W.D., Mund, U., R€ocker, L. & Stosoy, H. 1975. Low pressure system and blood volume regulating hormones after prolonged exercise. In: S.B. Ag, (ed) Metabolic Adaptation to Prolonged Physical Exercise, pp. 315–321. Birkha¨ user, Lausanne.
- Kirsch, K.A., Rocker, L., von Ameln, H. & Hrynyschyn, K. 1986. The cardiac filling pressure following exercise and thermal stress. Yale J Biol Med 59, 257–265.
- Kjellberg, S.R., Rudhe, U. & Sjostrand, T. 1949a. Increase of the amount of hemoglobin and blood volume in connection with physical training. Acta Physiol Scand 19, 146– 151.
- Kjellberg, S.R., Rudhe, U. & Sjostrand, T. 1949b. The relation of the cardiac volume to the weight and surface área of the body, the blood volume and the physical capacity for work. Acta Radiol 31, 113–122.
- Klausen, K., Secher, N.H., Clausen, J.P., Hartling, O. & Trap-Jensen, J. 1982. Central and regional circulatory adaptations to one-leg training. Journal of Applied Physiology Respiratory Environmental and Exercise Physiology 52, 976–983.
- Knuttgen, H.G., Nordesj€o, L.O., Ollander, B. & Saltin, B. 1973. Physical conditioning through interval training with young male adults. Med Sci Sports Exerc 5, 220–226.
- Levine, B.D. 2008. VO2max: what do we know, and what do we still need to know? J Physiol 586, 25–34.
- Levine, B.D., Lane, L.D., Buckey, J.C., Friedman, D.B. & Blomqvist, C.G. 1991. Left ventricular pressure-volume and Frank-Starling relations in endurance athletes. Implications for orthostatic tolerance and exercise performance. Circulation 84, 1016–1023.
- Lundby, C. & Jacobs, R.A. 2016. Adaptations of skeletal muscle mitochondria to exercise training. Exp Physiol 101, 17–22.
- Lundby, C. & Montero, D. 2015. CrossTalk opposing view: diffusion limitation of O2 from microvessels into muscle does not contribute to the limitation of VO2 max. J Physiol 593, 3759–3761.
- Lundby, C. & Robach, P. 2015. Performance enhancement: what are the physiological limits? Physiology (Bethesda) 30, 282–292.
- Lundby, C., Gassmann, M. & Pilegaard, H. 2006a. Regular endurance training reduces the exercise induced HIF-1alpha and HIF-2alpha mRNA expression in human skeletal muscle in normoxic conditions. Eur J Appl Physiol 96, 363–369.
- Lundby, C., Sander, M., van Hall, G., Saltin, B. & Calbet, J.A. 2006b. Maximal exercise and muscle oxygen extraction in acclimatizing lowlanders and high altitude natives. J Physiol 573, 535–547.
- Lundby, C., Boushel, R., Robach, P., Moller, K., Saltin, B. & Calbet, J.A. 2008. During hypoxic exercise some vasoconstriction is needed to match O2 delivery with O2 demand at the microcirculatory level. J Physiol 586, 123–130.
- Macpherson, R.E., Hazell, T.J., Olver, T.D., Paterson, D.H. & Lemon, P.W. 2011. Run sprint interval training improves aerobic performance but not maximal cardiac output. Med Sci Sports Exerc 43, 115–122.
- Marshall, P., Al-Timman, J., Riley, R., Wright, J., Williams, S., Hainsworth, R. & Tan, L.B. 2001. Randomized controlled trial of home-based exercise training to evaluate cardiac functional gains. Clin Sci 101, 477–483.
- Mezzani, A. & Guazzi, M. 2016. Balancing the evidence on the cardiovascular determinants of oxygen uptake improvement after endurance training in the elderly: What are the next steps? Eur J Prev Cardiol 23, 730–732.
- Montero, D. & D_ıaz-Ca~nestro, C. 2016. Endurance training and maximal oxygen consumption with ageing: role of maximal cardiac output and oxygen extraction. Eur J Prev Cardiol 23, 733–743.
- Montero, D., Cathomen, A., Jacobs, R.A., Fl€uck, D., de Leur, J., Keiser, S., Bonne, T., Kirk, N., Lundby, A.-K. & Lundby, C. 2015a. Haematological rather than skeletal muscle adaptations contribute to the increase in peak oxygen uptake induced by moderate endurance training. J Physiol 593, 4677–4688.
- Montero, D., Dıaz-Canestro, C. & Lundby, C. 2015b. Endurance training and V O2max: role of maximal cardiac output and oxygen extraction. Med Sci Sports Exerc 47, 2024–2033.
- Montero, D., Rauber, S., Goetze, J.P. & Lundby, C. 2016. Reduction in central venous pressure enhances erythropoietin synthesis: role of volume-regulating hormones. Acta Physiol (Oxf) 218, 89–97.
- Morris, N., Gass, G., Thompson, M., Bennett, G., Basic, D. & Morton, H. 2002. Rate and amplitude of adaptation to intermittent and continuous exercise in older men. Med SciSports Exerc 34, 471–477.
- Mundry, R. & Nunn, C.L. 2009. Stepwise model fitting and statistical inference: turning noise into signal pollution. Am Nat 173, 119–123.
- Murias, J.M., Kowalchuk, J.M. & Paterson, D.H. 2010a. Mechanisms for increases in V O2max with endurance training in older and young women. Med Sci Sports Exerc 42, 1891–1898.
- Murias, J.M., Kowalchuk, J.M. & Paterson, D.H. 2010b. Time course and mechanisms of adaptations in cardiorespiratory fitness with endurance training in older and Young men. J Appl Physiol (1985), 108, 621–627.
- Nordesj€o, L.O. 1974. The effect of quantitated training on the capacity for short and prolonged work. Acta Physiol Scand Suppl 405, 1–54.
- Panebianco, R.A., Stachenfeld, N., Coplan, N.L. & Gleim, G.W. 1995. Effects of blood donation on exercise performance in competitive cyclists. Am Heart J 130, 838–840.
- Pedersen, B.K. & Saltin, B. 2015. Exercise as medicine – evidence for prescribing exercise as therapy in 26 different chronic diseases. Scand J Med Sci Sports 25, 1–72.
- Prud’homme, D., Bouchard, C., Leblanc, C., Landry, F. & Fontaine, E. 1984. Sensitivity of maximal aerobic power to training is genotype-dependent. Med Sci Sports Exerc 16, 489–493.
- Rankinen, T., Wolfarth, B., Simoneau, J.-A., Maier-Lenz, D., Rauramaa, R., Rivera, M.A., Boulay, M.R., Chagnon, Y.C., P_erusse, L., Keul, J. & Bouchard, C. 2000. No association between the angiotensin-converting enzyme ID polymorphism and elite endurance athlete status. J Appl Physiol (1985) 88, 1571–1575.
- Rankinen, T., Fuku, N., Wolfarth, B., Wang, G., Sarzynski, M.A., Alexeev, D.G., Ahmetov, I.I., Boulay, M.R., Cieszczyk, P., Eynon, N. et al. 2016. No evidence of a common DNA variant profile specific to world class endurance athletes. PLoS ONE 11, e0147330.
- Robach, P., Boisson, R.C., Vincent, L., Lundby, C., Moutereau, S., Gergele, L., Michel, N., Duthil, E., Feasson, L. & Millet, G.Y. 2014. Hemolysis induced by an extreme mountain ultra-marathon is not associated with a decrease in total red blood cell volume. Scand J Med Sci Sports 24, 18–27.
- Robinson, S., Edwards, H.T. & Dill, D.B. 1937. New records in human power. Science 85, 409–410.
- Roecker, L., Kowoll, R., Fraszl, W., Battal, K., Brechtel, L., Brachmann, S., Meier-Buttermilch, R., Gunga, H.C., Stangl, A. & Kiesewetter, H. 2006. Observation of serum erythropoietin concentrations in female athletes for up to eight days after a marathon run. Clin Lab 52, 511–513.
- Ross, R., de Lannoy, L. & Stotz, P.J. 2015. Separate effects of intensity and amount of exercise on interindividual cardiorespiratory fitness response. Mayo Clin Proc 90, 1506– 1514.
- Rud, B., Foss, O., Krustrup, P., Secher, N.H. & Hallen, J. 2012. One-legged endurance training: leg blood flow and oxygen extraction during cycling exercise. Acta Physiol (Oxf) 205, 177–185.
- Rundqvist, H., Rullman, E., Sundberg, C.J., Fischer, H., Eisleitner, K., Stahlberg, M., Sundblad, P., Jansson, E. & Gustafsson, T. 2009. Activation of the erythropoietin receptor in human skeletal muscle. Eur J Endocrinol 161, 427–434.
- Saltin, B., Blomqvist, G., Mitchell, J.H., Johnson, R.L. Jr, Wildenthal, K. & Chapman, C.B. 1968. Response to exercise after bed rest and after training. Circulation 38, VII1–VII78.
- Sarzynski, M.A., Ghosh, S. & Bouchard, C. 2016. Genomic and transcriptomic predictors of response levels to endurance exercise training. J Physiol. doi: 10.1113/JP272559.
- Sawka, M.N., Convertino, V.A., Eichner, E.R., Schnieder, S.M. & Young, A.J. 2000. Blood volume: importance and adaptations to exercise training, environmental stresses, and trauma/sickness. Med Sci Sports Exerc 32, 332–348.
- Schmidt, W. & Prommer, N. 2008. Effects of various training modalities on blood volume. Scand J Med Sci Sports 18(Suppl 1), 57–69.
- Schmidt, W., Eckardt, K.U., Hilgendorf, A., Strauch, S. & Bauer, C. 1991. Effects of maximal and submaximal exercise under normoxic and hypoxic conditions on serum erythropoietin level. Int J Sports Med 12, 457–461.
- Schwandt, H.J., Heyduck, B., Gunga, H.C. & Rocker, L. 1991. Influence of prolonged physical exercise on the erythropoietin concentration in blood. Eur J Appl Physiol Occup Physiol 63, 463–466.
- Shields, R. 2011. Common disease: are causative alleles common or rare? PLoS Biol 9, e1001009.
- Simonson, T.S. 2015. Altitude adaptation: a glimpse through various lenses. High Alt Med Biol 16, 125–137.
- Skinner, J.S., Jask_olski, A., Jask_olska, A., Krasnoff, J., Gagnon, J., Leon, A.S., Rao, D.C., Wilmore, J.H. & Bouchard, C. 2001. Age, sex, race, initial fitness, and response to training: the HERITAGE Family Study. J Appl Physiol (1985) 90, 1770–1776.
- Spence, A.L., Naylor, L.H., Carter, H.H., Buck, C.L., Dembo, L., Murray, C.P., Watson, P., Oxborough, D.,
- George, K.P. & Green, D.J. 2011. A prospective randomised longitudinal MRI study of left ventricular adaptation to endurance and resistance exercise training in humans. J Physiol 589, 5443–5452.
- Spina, R.J., Ogawa, T., Martin, W.H., Coggan, A.R., Holloszy, J.O. & Ehsani, A.A. 1992. Exercise training prevents decline in stroke volume during exercise in young healthysubjects. J Appl Physiol 72, 2458–2462.
- Spina, R.J., Ogawa, T., Kohrt, W.M., Martin, W.H. 3rd, Holloszy, J.O. & Ehsani, A.A. 1993a. Differences in cardiovascular adaptations to endurance exercise training between older men and women. J Appl Physiol (1985) 75, 849–855.
- Spina, R.J., Ogawa, T., Miller, T.R., Kohrt, W.M. & Ehsani, A.A. 1993b. Effect of exercise training on left ventricular performance in older women free of cardiopulmonary disease. Am J Cardiol 71, 99–104.
- Spina, R.J., Turner, M.J. & Ehsani, A.A. 1998. beta-adrenergic- mediated improvement in left ventricular function by exercise training in older men. American Journal of Physiology- Heart and Circulatory Physiology 274, H397–H404.
- Taylor, H.L., Buskirk, E. & Henschel, A. 1955. Maximal oxygen intake as an objective measure of cardio-respiratory performance. J Appl Physiol 8, 73–80.
- Thompson, H. 2012. Performance enhancement: superhuman athletes. Nature 487, 287–289.
- Wagner, P.D. 1992. Gas exchange and peripheral diffusion limitation. Med Sci Sports Exerc 24, 54–58.
- Wagner, P.D. 2015. CrossTalk proposal: diffusion limitation of O2 from microvessels into muscle does contribute to the limitation of VO2 max. J Physiol 593, 3757–3758.
- Wang, E., Næss, M.S., Hoff, J., Albert, T.L., Pham, Q., Richardson, R.S. & Helgerud, J. 2014. Exercise-traininginduced changes in metabolic capacity with age: the role of central cardiovascular plasticity. Age 36, 665–676.
- Warburton, D.E., Gledhill, N. & Quinney, H.A. 2000. Blood volume, aerobic power, and endurance performance: potential ergogenic effect of volume loading. Clin J Sport Med 10, 59–66.
- Warburton, D.E., Haykowsky, M.J., Quinney, H.A., Blackmore, D., Teo, K.K., Taylor, D.A., McGavock, J. & Humen, D.P. 2004. Blood volume expansion and cardiorespiratory function: effects of training modality. Med Sci Sports Exerc 36, 991–1000.
- Weight, L.M., Alexander, D., Elliot, T. & Jacobs, P. 1992. Erythropoietic adaptations to endurance training. Eur J Appl Physiol Occup Physiol 64, 444–448.
- Weiss, K.M. 2008. Tilting at Quixotic Trait Loci (QTL): an evolutionary perspective on genetic causation. Genetics 179, 1741–1756.
- Weng, T.P., Huang, S.C., Chuang, Y.F. & Wang, J.S. 2013. Effects of interval and continuous exercise training on CD4 lymphocyte apoptotic and autophagic responses to hypoxic stress in sedentary men. PLoS ONE 8, e80248.

