
26 Jun Adaptaciones al Entrenamiento de la Resistencia y de la Fuerza
David C. Hughes,1Stian Ellefsen,2,3y Keith Baar1
1Department of Neurobiology, Physiology and Behavior, Functional Molecular Biology Laboratory, University of California Davis, Davis, California 95616.
2Section of Sports Sciences, Lillehammer University College, 2604 Lillehammer, Noruega.
3Innlandet Hospital Trust, 2380 Brumunddal, Noruega.
La capacidad de rendimiento físico humano se puede mejorar con entrenamiento físico prolongado, ya sea de resistencia o de fuerza. La capacidad de adaptarse a través del entrenamiento físico permite que los individuos alcancen su mejor rendimiento en un evento deportivo y/o mantengan la aptitud física máxima durante toda la vida. Nuestro impulso continuo para entender cómo prescribir ejercicio para maximizar los resultados de salud y/o rendimiento hace que nuestro conocimiento sobre las adaptaciones que se producen como resultado del ejercicio siga evolucionando. Esta revisión se centrará en las ideas actuales y nuevas sobre las adaptaciones al entrenamiento de la resistencia y de la fuerza, y destacará aspectos importantes que siguen vigentes en cuanto a cómo nos adaptamos al entrenamiento.
En respuesta al ejercicio, los seres humanos alteran el fenotipo de su músculo esquelético; alterando el almacenamiento de nutrientes, la cantidad y el tipo de enzimas metabólicas, la cantidad de proteína contráctil y la rigidez del tejido conectivo, sólo por nombrar algunas de las adaptaciones. El cambio en el fenotipo es el resultado de la frecuencia, intensidad y duración del ejercicio en combinación con la edad, la genética, el género, el abastecimiento de combustible y los antecedentes de entrenamiento del individuo (Joyner y Coyle 2008; Brooks 2011). Por otra parte, a pesar de que frecuentemente el ejercicio se define como un estímulo único y hemos observado respuestas generalizadas, habrá variaciones en la forma en que cualquier individuo pueda responder al entrenamiento físico en función de aspectos que conocemos y (probablemente) de otros tantos aspectos que no conocemos. Como es la norma, este artículo se centrará en los aspectos que conocemos, pero destacará importantes preguntas que aún no han sido respondidas en cuanto a cómo nos adaptamos al entrenamiento.
El ejercicio generalmente se separa en actividades aeróbicas/resistencia y actividades de potencia/fuerza. El ejercicio de resistencia se realiza clásicamente contra una carga relativamente baja durante una larga duración, mientras que el ejercicio de la fuerza se realiza contra una carga relativamente alta durante una corta duración. Sin embargo, los ejercicios de resistencia pura o de fuerza pura son raros. Muchas actividades combinan resistencia y fuerza y este tipo de entrenamiento se conoce como entrenamiento concurrente. Por otra parte, trabajos recientes que demuestran que el ejercicio corto de alta intensidad puede producir adaptaciones de resistencia y que el ejercicio de baja carga que se acerca a la falla puede producir adaptaciones de la fuerza han desafiado nuestra comprensión de qué tipo de ejercicio produce cada cambio fenotípico en el músculo. Se sabe que el entrenamiento clásico de resistencia produce un aumento del gasto cardíaco, el consumo máximo de oxígeno y la biogénesis mitocondrial (Holloszy y Coyle, Foy et al., 1986). La mejora general en los tejidos centrales y periféricos permite una mejor economía de ejercicio y una mayor capacidad para que el individuo pueda correr por distancias y tiempos más largos (Brooks 2011). Por el contrario, el entrenamiento de la fuerza produce aumentos en el tamaño del músculo (área transversal [CSA]), adaptaciones nerviosas (rendimiento motor) y mejora en la fuerza (producción de fuerza máxima) (Narici et al., 1989, Staron et al., 1991 Pyka et al., 1994, Häkkinen et al., 1998a). Estas alteraciones positivas en la capacidad física hacen que el individuo sea más fuerte, más poderoso y pueda mantener una mejor calidad de vida a lo largo de la vida (Visser et al., 2005; Goodpaster et al. 2006; Newman et al., 2006).
De hecho, las adaptaciones tanto del entrenamiento de la resistencia como del entrenamiento de la fuerza no sólo contribuyen a la excelencia deportiva potencial sino que, en la mayoría de los casos, favorecen la aparición tardía de enfermedades relacionadas con la edad (McGregor et al 2014, Zampieri et al 2015, Cartee Et al 2016). Este artículo se centra en conceptos recientes y en la nueva bibliografía publicada en el campo del entrenamiento de la resistencia y de la fuerza, y cómo esta nueva información ha cambiado el dogma de cómo el ejercicio mejora el rendimiento físico y la adaptación general. Finalmente, en la última parte de este artículo se discutirá brevemente la combinación de ejercicios de resistencia y de fuerza, y los recientes avances en nuestra comprensión del entrenamiento concurrente.
Entrenamiento de la Resistencia
El entrenamiento de la resistencia produce adaptaciones en el sistema cardiovascular y en el sistema musculo esquelético que permiten una mejora general de la capacidad y del rendimiento físicos (Brooks 2011). Las adaptaciones locales del músculo esquelético, tales como el incremento en la biogénesis mitocondrial y en la densidad capilar, mejoran la capacidad del cuerpo para transportar y utilizar oxígeno para generar energía y por lo tanto permiten retrasar la aparición de fatiga muscular durante el rendimiento aeróbico prolongado (Joyner y Coyle 2008 ). La mitocondria es la principal organela encargada de la producción de energía a través de la generación de adenosin trifosfato (ATP) por medio del sistema de transporte de electrones (ETS), y utiliza sustratos generados en el ciclo de los ácidos tricarboxílicos (TCA) (Egan y Zierath 2013, Bishop et al., 2014). Estudios recientes han comenzado a investigar el impacto de las adaptaciones en la biogénesis de mitocondrias inducidas por el ejercicio desde la perspectiva del contenido y la función mitocondrial con diferentes paradigmas de intensidad de ejercicio (Serpiello et al., 2016a, MacInnis et al., 2016). Los estudios que han investigado el papel de la intensidad y el volumen de ejercicio en las adaptaciones mitocondriales se han realizado utilizando entrenamiento prolongado y de larga distancia (LSD), entrenamiento de sprint intervalado (SIT; series máximas de aprox. 30 seg.) y entrenamiento intervalado de alta intensidad (HIIT; series máximas de 1-4 min) (Gibala et al., 2014). El entrenamiento tradicional LSD implica que un individuo debe mantener una una carga de trabajo submáxima durante un largo período de tiempo o recorrer exitosamente una distancia/tiempo fijos con una producción de potencia superior a la promedio (Coyle 1995). Por otro lado, los entrenamientos HIIT y SIT requieren que el individuo realice series repetidas a una intensidad cercana a la máxima durante un corto período de tiempo con un volumen de entrenamiento reducido (Laursen y Jenkins 2002, Gibala et al., 2006). Muchos estudios han observado similitudes en las adaptaciones de marcadores de mitocondriales (p. ej., Coactivador 1α del receptor gama activado por el factor proliferador de peroxisomas [PGC-lα]) y en la capacidad oxidativa del músculo esquelético en ambos modelos de entrenamiento (Gibala et al 2009, Little et al., 2010b; 2011; Jacobs et al. 2013b; Cochram et al. 2014) y, por lo tanto, se ha señalado que los entrenamientos HIIT/SIT serían una estrategia eficaz en el tiempo para mejorar las adaptaciones aeróbicas (Gibilla y McGee, 2008; Gillen y Gibala, 2013).
Estudios más recientes han comenzado a abordar directamente la importancia de la intensidad del ejercicio en comparación con el volumen en relación al contenido y la función mitocondrial (Daussin et al, 2008, Jacobs et al., 201b, Cochran et al., 2014, Granata et al., 2016b, Maclnnis et al 2016). Granata y colegas (2016b) realizaron un estudio con varones jóvenes moderadamente entrenados en el cual utilizaron los tres protocolos de ejercicio (LSD, HIIT y SIT), equiparando el volumen en los grupos tradicionales y en HIIT. Después de 4 semanas de entrenamiento, los investigadores observaron un aumento del 25% en la respiración mitocondrial máxima sólo en el grupo SIT, pero no observaron cambios en los grupos LSD o HIIT. El aumento del nivel de respiración mitocondrial dentro del grupo SIT fue acompañado por cambios en PGC-lα, p53 y en el contenido de proteínas PHF20. La PHF20 es importante tanto para la estabilización como para la regulación por incremento de p53 (Cui et al., 2012, Park et al., 2012), mientras que p53 es un supresor de tumores y participa en la regulación de la función mitocondrial (Matoba et al., 2006; Park et al. 2009). En contraste con el estudio de Granata, se ha observado que el HIIT solo influye en el contenido y en la respiración mitocondrial (Daussin et al., 2008; Jacobs et al., 2013b). Jacobs et al. (2013b) observaron aumento de la respiración y alteraciones en el contenido mitocondrial (medido por la actividad de la citocromo c oxidasa [COX]) que provocaron un aumento de la capacidad de realizar ejercicios después de sólo 2 semanas de entrenamiento HIIT. Otro apoyo para las adaptaciones mitocondriales con HIIT proviene de un estudio que se realizó intra-sujeto donde se observó que 2 semanas de entrenamiento producían un aumento en la densidad, volumen y respiración mitocondrial (Maclnnis et al., 2016). Las discrepancias entre estos estudios pueden deberse a diferencias en el estado de entrenamiento de los sujetos, el diseño experimental y a las medidas metodológicas implementadas para evaluar las adaptaciones mitocondriales. El estudio óptimo para abordar de manera concluyente esta cuestión debería utilizar los tres modelos de entrenamiento y un diseño cruzado intra-sujeto.
Cuando la intensidad del entrenamiento se mantiene y sólo se realizan variaciones en el volumen, nuevamente se observan variaciones en la adaptación mitocondrial por medio de un diseño en el que 10 sujetos realizaron HIIT una vez al día tres veces a la semana, luego dos veces al día tres veces a la semana y una vez al día dos veces a la semana. Granata y colegas. (Granata et al., 2016b) demostraron que la respiración mitocondrial y la actividad citrato sintasa (CS) aumentaron (aprox. 50%) sólo durante el período de entrenamiento de alto volumen. El aumento de la respiración mitocondrial fue acompañado por un aumento en la cadena de transporte de electrones (ETS) y de proteínas reguladoras, tales como PGC-lα, p53 y PHF20. Luego de 2 semanas de disminución del volumen de entrenamiento, la respiración mitocondrial específica permaneció alta, y la ligera disminución en la actividad de CS fue el único signo de desentrenamiento. En general, estos estudios sugieren que el entrenamiento de alta intensidad es importante para aumentar la actividad mitocondrial, mientras que un mayor volumen de entrenamiento es necesario para aumentar la masa mitocondrial (Figura 1) (MacInnis et al., 2016). Sin embargo, el principal marcador que se utiliza para determinar alteraciones en el contenido mitocondrial es la actividad CS. Estudios futuros deberían utilizar microscopía electrónica para identificar otros marcadores que puedan reflejar mas claramente la actividad mitocondrial (por ejemplo, localización en subsarcolemma vs. localización intermiofibrilar de las mitocondrias) y cambios en la masa del músculo esquelético.
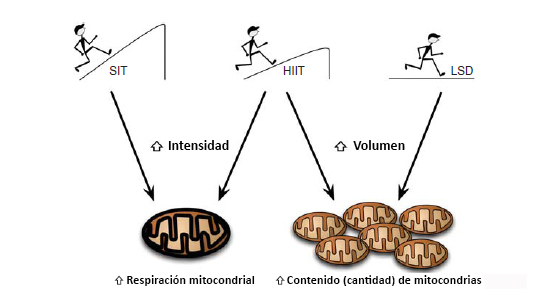
Figura 1. Diagrama esquemático de la intensidad y del volumen del entrenamiento sobre la respiración mitocondrial frente a adaptaciones de contenido mitocondrial obtenidas mediante entrenamiento de resistencia. La evidencia reciente sugiere que los aumentos en la intensidad del ejercicio (entrenamiento intervalado de esprint [SIT], entrenamiento intervalado de alta intensidad [HIIT]) producen una mayor respiración y función mitocondrial, mientras que el ejercicio de resistencia prolongado de baja intensidad y de alto volumen (entrenamiento de larga distancia lento [LSD]) permitiría aumentar el contenido mitocondrial dentro del músculo esquelético.
Generalmente el PGC-1α ha sido señalado como el “regulador maestro de la biogénesis mitocondrial” y un componente fundamental de las adaptaciones inducidas por el ejercicio durante el entrenamiento de la resistencia (Baar et al., 2002; Pilegaard et al., 2003; Little et al. 2010a). En los últimos años, surgió la proteína p53, como un actor clave en el metabolismo de sustratos y en la biogénesis mitocondrial (Park et al., 2009; Saleem y Hood 2013; Bartlett et al., 2014). La p53 fue la primera proteína supresora tumoral descubierta (Baker et al., 1989, Nigro et al., 1989). En este papel, p53 regula la detención del ciclo celular, la apoptosis, la angiogénesis, la reparación del ADN, y la senescencia celular (Levine et al., 2006). Los estudios iniciales realizados con ratones knockout (KO) que carecían de p53 identificaron un papel adicional para esta proteína en el control del contenido mitocondrial, debido a que los ratones KO presentaban una menor cantidad de mitocondrias tanto en el subsarcolema como entre las miofibrillas además de una reducción de la actividad COX y PGC-1α en comparación con los animales salvajes (Saleem et al., 2009). Además, se observó que la pérdida de p53 y la consiguiente disminución del contenido y la función mitocondrial provocaban una disminución en la capacidad y en el rendimiento físico (Parket al., 2009). Los mecanismos propuestos en la actualidad para la forma en que p53 puede regular la biogénesis mitocondrial sostienen que interactuaría con elgenoma mitocondrial y específicamente tendría interacción con el factor de transcripción mitocondrial A (Tfam) (Saleem y Hood 2013). Saleem y Hood (2013) informaron que, con ejercicio agudo y contracción muscular, p53 se transloca desde el núcleo y modula positivamente la actividad de Tfam. Actualmente en estudios realizados en humanos, Bartlett et al. (2012) observaron una mayor fosforilación de p53, 3 horas después del ejercicio, aunque esta alteración en la fosforilación de p53 se produjo después de series agudas de ejercicios de resistencia continuos y de entrenamiento HIIT. En contraste, Granata y colegas observaron que p53 aumenta con el entrenamiento de esprint máximo, pero el entrenamiento de resistencia continuo o HIIT no tienen efecto sobre el contenido de p53 (Granata et al., 2016b). Es importante señalar que la regulación de p53 puede no sólo estar influenciada por la intensidad del ejercicio, sino también por el estado nutricional del músculo activo durante las sesiones de entrenamiento, por ejemplo, por la reducción en la disponibilidad de carbohidratos (Bartlett et al., 2013). Se necesitan investigaciones futuras que permitan comprender la evolución en el tiempo de la activación y participación de p53 en la biogénesis mitocondrial en función al ejercicio de resistencia (Bartlett et al., 2014). La comprensión de esta cascada de señalización no sólo será importante desde una perspectiva de rendimiento humano, sino también desde un punto de vista de la salud debido a que el ejercicio podría ser utilizado para apoyar los tratamientos en la terapia contra el cáncer (Saleem y Hood 2013).
Además de las alteraciones en el suministro de oxígeno, el metabolismo de los sustratos y la masa mitocondrial dentro del músculo esquelético después del entrenamiento de resistencia, existen otros factores que intervienen para mejorar el rendimiento físico y mejorar la economía de la carrera (Barnes y Kilding, 2015). Uno de estos factores es la rigidez de la unidad músculo-matriz extracelular-tendón (ECM), porque las adaptaciones dentro de este sistema mejorarán la capacidad del cuerpo de almacenar y utilizar la energía elástica más eficientemente. Un aumento en el almacenamientode la energía elástica produce un menor tiempo de contacto con el suelo y un menor costo energético (Arampatzis et al., 2006; Fletcher et al., 2010). De hecho, los corredores que exhiben y/o desarrollan un sistema musculo-tendinoso más largo y más rígido parecen tener un menor consumo de oxígeno (VO2) cuando realizan ejercicios en velocidades de carrera submáximas (Craib et al., 1996; Albracht and Arampatzis 2013; Barnes et al., 2014). Un segundo factor que participa en la mejora de la economía de carrera y de ciclismo es la adaptación nerviosa. Los patrones de reclutamiento muscular varían mucho entre individuos altamente entrenados y sus contrapartes novatos (Paavolainen et al., 1999b, Chapman et al., 2008). Los individuos altamente entrenados pueden tener la capacidad de producir mayor coactivación muscular, rigidez de las piernas y mayor actividad muscular excéntrica o concéntrica, lo que permite un uso más eficiente de la energía elástica almacenada y reduce el costo metabólico del ejercicio (Paavolainen et al., 1999b; Heise et al., 2008). Por el contrario, las intervenciones de estiramiento utilizadas para mejorar la flexibilidad tienden a disminuir la economía, aunque estos resultados han sido contradictorios (Craib et al., 1996, Nelson y otros, Shrier 2004). Algunas de las posibles razones que pueden haber contribuido con la confusión en la evidencia sobre el estiramiento incluyen la duración del programa de intervención (agudo vs. crónico), la influencia del género en los estudios combinados, los diseños metodológicos y el nivel de familiarización con la cinta rodante (Craib et al., 1996), Nelson et al. 2001; Shrier 2004, Allison et al., 2008, Trehearn y Buresh, 2009).
El entrenamiento para mejorar la rigidez de los tejidos conectivos y los componentes neuromusculares es muy diferente al entrenamiento de resistencia clásico. En este caso, el entrenamiento se basa en la fuerza/potencia y en ejercicios pliométricos para aumentar las adaptaciones neuromusculares (por ejemplo, la activación muscular, el reclutamiento de unidades motoras) y la rigidez de la unidad músculo-ECM-tendón (Storen et al., 2008; Yamamoto et al. 2008; Beattie et al., 2014). Un buen ejemplo de este trabajo es un estudio previo de Paavolainen y colegas (1999a) que investigaron el impacto en el rendimiento de resistencia del entrenamiento de fuerza de tipo explosivo en atletas altamente entrenados en resistencia (prueba contrarreloj de 5 km, economía de la carrera, etc.). Después de 9 semanas de entrenamiento, los investigadores observaron una mejora del 3% en una prueba contrarreloj de 5 km y una tendencia hacia un menor VO2máx. El mejor rendimiento se debió en gran medida a las mejoras en la economía de la carrera. Investigaciones posteriores observaron un efecto aditivo de incorporar un programa de entrenamiento de la fuerza al entrenamiento de atletas predominantemente entrenados en resistencia, tanto durante la pretemporada como en la temporada (Rønnestad et al., 2010). Los mecanismos propuestos para estas mejoras en el rendimiento de la resistencia son una mejor función neural (contracción voluntaria máxima, tasa de desarrollo de la fuerza [RFD]), aumento de las fibras musculares del tipo IIA (menos fatigables) y aumento de la rigidez del sistema músculo-ECM-tendón (Aagaard y Andersen 2010, Aagaard et al., 2011). Además, se ha observado que la adición del entrenamiento de fuerza produce una mejora en la economía de ejercicio mayor a la del entrenamiento de resistencia solo (Sunde et al., 2010; Beatty et al., 2015; Vikmoen et al., 2015) y la inclusión de entrenamiento de fuerza puede mejorar el rendimiento durante las etapas de la competencia posterior (Rønnestad et al., 2011). Una forma de distinguir entre la rigidez del sistema ECM-muscular y las adaptaciones nerviosas sería realizar el entrenamiento fuerza /pliométrico con una pierna y determinar si la transferencia cruzada entre miembros ha producido una mejora en el rendimiento en la extremidad opuesta, lo que indicaría una adaptación neuronal (ver más adelante). Sin embargo, aún no se han realizado estos experimentos con ejercicios de resistencia. Por otra parte, es necesario tener cuidado con respecto utilizar entrenamiento de fuerza para mejorar el rendimiento de resistencia, ya que también hay evidencia que sugiere que el aumento en el volumen de entrenamiento de la resistencia y de fuerza juntos puede provocar alteraciones tanto en las adaptaciones como en el rendimiento (Jones et al. Al., 2013).
La última adaptación al entrenamiento con ejercicios de resistencia que queremos destacar es la hipertrofia y el crecimiento muscular (Harber et al 2009b, 2012; Konopka y Harber2014). Se ha observado que durante un programa de entrenamiento de resistencia de 12 semanas, la masa muscular aumenta entre un 7% y un 11% (Konopka et al., 2010; Harber et al., 2012). Este aumento de la masa muscular es comparable con el que produce el entrenamiento de fuerza durante el mismo período de tiempo (Trappe et al., 2011; Mitchell et al., 2012). Estos aumentos informados de la masa muscular con entrenamiento de resistencia se han observado predominantemente en el músculo cuádriceps, el modo de ejercicio utilizado fue el ciclismo, y los individuos que realizaban el entrenamiento tenían un nivel limitado de experiencia en ejercicio y/o un estilo de vida sedentario (Konopka y Harber, 2014). Por otra parte, parecería que la hipertrofia en el músculo cuádriceps se produce con el entrenamiento motor clásico de resistencia si la frecuencia y carga de entrenamiento son lo suficientemente altas (Konopka y Harber 2014). Desde una perspectiva mecanicista, estudios agudos observaron aumentos en la síntesis de proteínas musculares (MPS) con ejercicios aeróbicos, independientemente de la edad (Short et al., 2004; Harberet et al., 2009ª, 2010 Durham et al., 2010). Por ejemplo, Short y colegas (2004) observaron un aumento del 22% en la síntesis de proteínas musculares (MPS) con 4 meses de ciclismo (hasta 45 minutos a 80% de frecuencia cardíaca máxima, 3-4 días/semana). Los aumentos observados en MPS gracias al ejercicio aeróbico no parecen ser impulsados por el complejo 1 del blanco mecanicista del complejo de rapamicina 1 (mTORC1) (Durham et al., 2010; Philp et al., 2015). Utilizando rapamicina (un inhibidor de la activación de mTORC1), Philp y colaboradores (2015) observaron aumentos en las tasas de síntesis de proteínas musculares y mitocondriales después de ejercicios de resistencia en ratas, incluso cuando la señalización de mTORC1 había sido completamente suprimida. Los resultados de Philp y sus colegas se oponen a lo observado en estudios previos donde se observó un aumento en la MPS y en la activación de mTORC1 con ejercicio aeróbico (Mascher et al., 2011; Edgett et al., 2013; Di Donato et al., 2014). Como se mencionó anteriormente con otras facetas de la adaptación de resistencia, el impacto de la intensidad y modalidad de ejercicio, y del nivel de reclutamiento de las fibras musculares puede ser una posible explicación para el contraste observado entre los resultados de los estudios. Específicamente, la hipertrofia se ha observado casi exclusivamente después de entrenamiento para ciclismo. Estudios futuros deben buscar implementar otros modos de ejercicio de resistencia como correr utilizando diferentes cargas/modos (en ascenso o en el llano) con el mismo volumen para determinar si esto afecta la MPS de forma aguda y el tamaño muscular después del entrenamiento. Desde un punto de vista mecanicista, los estudios posteriores deberán evaluar cual es el efecto de la alimentación, a señalización de miostatina y de otros mecanismos independientes de mTOR sobre la hipertrofia muscular relacionada con la resistencia.
Entrenamiento de la Fuerza
El entrenamiento de la fuerza produce un aumento en la fuerza y en la potencia muscular como resultado de adaptaciones neuromusculares, aumentos en el área transversal (CSA) muscular y alteraciones en la rigidez del tejido conectivo (Knuttgen y Kraemer 1987). El resultado es un rápido aumento inicial de la fuerza a medida que el individuo aprende un ejercicio (Figura 2) (Sale 1988), seguido por una progresión lenta mientras el músculo crece (Fry 2004, Folland y Williams 2007; Wernbom et al., 2007). El entrenamiento de fuerza ha variado clásicamente la carga externa y el volumen para mejorar tanto la fuerza neuromuscular como el CSA muscular, generalmente se entrena con una carga entre 1RM (repetición máxima) y 10 RM y un volumen de 4 a 12 repeticiones. Las adaptaciones al entrenamiento de sobrecarga generalmente se pueden observar después de 8 a 12 semanas (Hakkkinen et al., 1998b, Folland y Williams 2007). Sin embargo, algunos estudios han observado aumentos en la fuerza muscular y CSA después de sólo 2 a 4 semanas (Staron et al., 1994; Seynnes et al., 2007; DeFreitas et al., 2011, Brook y otros, 2015, Damas y otros, 2016). Este aumento temprano en la fuerza probablemente se deba a adaptaciones neuromusculares y del tejido conectivo (Sale 1988), mientras que los aumentos tempranos en el tamaño del CSA muscular pueden ser el resultado de edema (Damas et al., 2016).
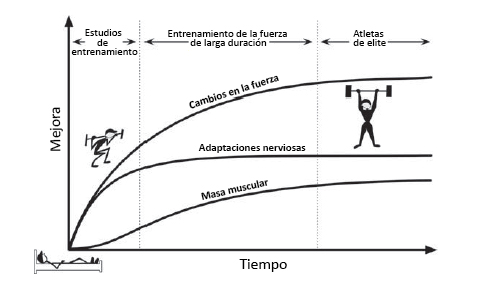
Figura 2. Alteraciones en la fuerza, masa y adaptaciones nerviosas producidas por el entrenamiento de la fuerza en el tiempo. Los estudios con ejercicios de fuerza (8 a 12 semanas de entrenamiento) demuestran un aumento temprano en la fuerza como resultado de las adaptaciones nerviosas. Con el entrenamiento de fuerza prolongado, la masa muscular aumenta lentamente y produce los cambios de fuerza posteriores, luego de que las adaptaciones nerviosas comiencen a estabilizarse (meseta). Finalmente, en el nivel de élite, los individuos presentan pequeños cambios en las tres adaptaciones básicas que acompañan al entrenamiento de la fuerza. En este punto, se necesitan nuevos estímulos (posiblemente dirigidos a la matriz extracelular [ECM]) para aumentar la fuerza.
Debido a la rápida naturaleza de las adaptaciones neuromusculares y a la facilidad para medir los cambios en el CSA, la mayoría de los estudios preliminares en este campo se centraron en estas respuestas (Cureton et al., 1988, Narici et al., 1989, Staron et al., 1991, 1994). Las adaptaciones observadas dentro del sistema neuromuscular se han centrado en aumentos en la adquisición de habilidades del sistema nervioso y en el aumento de la activación máxima del músculo por medio de la sincronización de las unidades motoras, el reclutamiento muscular y la mayor activación neuronal (Enoka, 1988). En términos de hipertrofia, el objetivo principal de la adaptación ha sido el aumento de la CSA para las fibras musculares individuales, a través de la adición de sarcómeros en paralelo (Cureton et al., 1988; Staron et al., 1990). Los primeros estudios mecánicos se centraron en las alteraciones dentro del medio hormonal después de los ejercicios de fuerza agudos como posible factor de producción de hipertrofia (Kraemer et al., 1991, Haükkinen y Pakarinen 1993, McCall et al 1999). Sin embargo, la evidencia reciente parece poner en duda la hipótesis de que las hormonas provoquen hipertrofia y crecimiento muscular inducidos por el ejercicio (West et al., 2009 2010, 2012, Schroeder et al., 2013, Morton et al., 2016).
La importancia del componente nervioso central en las adaptaciones de fuerza es más evidente cuando se entrena una pierna y la otra no. En esta situación, el CSA muscular no varía en la pierna no entrenada, sin embargo, se produce un aumento significativo en la fuerza a partir del entrenamiento de la pierna contraria (Houston et al., 1983, Yasuda y Miyamura 1983, Munn et al., 2004, 2005). Un meta análisis sobre el efecto del entrenamiento con sobrecarga contralateral sugiere que la fuerza mejora un 7,6% en la extremidad no ejercitada (56% de lo que sucede en la extremidad ejercitada), con un entrenamiento de entre 15 y 48 sesiones (Munn et al., 2004; Carroll et al., 2006). Algunos de los mecanismos propuestos para este fenómeno son las adaptaciones musculares localizadas, la interacción cortical cruzada entre miembros y las adaptaciones en la excitabilidad de la médula espinal (Carroll et al., 2006). En última instancia, el entrenamiento con sobrecarga unilateral puede producir adaptaciones en el impulso nervioso que “se derraman” en la extremidad no entrenada y, además, la pierna no entrenada puede incorporar las adaptaciones neuromusculares que se producen en el sistema de control con este tipo de entrenamiento (Carroll et al. 2006). Recientemente, Kidgell y colegas (2015) observaron una mayor transferencia cruzada de fuerza en el grupo que utilizó carga excéntrica (47%) que el grupo de carga concéntrica (28%). Una de las posibles razones del mayor efecto con la carga excéntrica fue un mayor aumento en la excitabilidad corticoespinal, lo que se propuso como el mecanismo subyacente al efecto (Latella et al., 2012). Sin embargo, dado que se observó por primera vez en 1894 (Scripture et al., 1894), todavía entendemos muy poco sobre el efecto de entrenamiento de fuerza contralateral y el papel del ambiente sistémico en este fenómeno (Yasuda y Miyamura 1983; West et al., 2015).
Otra adaptación que se ha observado luego del entrenamiento de la fuerza es un aumento en la RFD (Aagaard et al., 2002, Suetta et al., 2004, Andersen y Aagaard, 2006, Maffiuletti et al., 2016). La RFD hace referencia a la tasa de aumento de la fuerza en el inicio de la contracción, es decir, representa la pendiente de la curva fuerza en función del tiempo (Sleivert y Wenger 1994, Aagaard et al., 2002). Un estudio previo realizado por Aagaard y col. (2002) demostró un aumento de 15% en RFD después de 14 semanas de entrenamiento de la fuerza pesado. Además, se observaron aumentos en la amplitud EMG y la tasa de aumento de EMG con el entrenamiento, lo que indica una mejora en el impulso nervioso. Esto sugiere que la RFD está relacionada con alteraciones en el impulso nervioso. Otros factores que regulan la RFD son el tipo de fibra muscular y la transferencia de fuerza. Estudios sobre el papel del tipo de fibra indican que las fibras de tipo II tienen una RFD mayor (Korhonen et al., 2006; Aagaard et al., 2007); por lo tanto, los aumentos de CSA de las fibras de tipo II con el entrenamiento de la fuerza complementarían el aumento en el impulso nervioso (Staron et al., 1990, 1991, Mero et al., 2013). Nuestra comprensión de cómo la transferencia de fuerza puede contribuir con la RFD está en pañales (Hughes et al., 2015). La red del citoesqueleto dentro del músculo transmite fuerza tanto a lo largo de la longitud de cada fibra muscular (longitudinalmente) como desde el centro hacia el exterior de la fibra (lateralmente) (Hughes et al., 2015). Es importante destacar que mas del 80% de la fuerza producida dentro de una fibra se transfiere lateralmente desde proteínas dentro de la fibra hacia proteínas ECM ubicadas fuera de la fibra (Ramaswamy et al., 2011). Los componentes clave del aparato de transferencia de fuerza incluyen proteínas intracelulares (titina, distrofina, etc.), complejos transicionales (complejo de glicoproteínas asociadas a la distrofina [DAGC] e integrinas) y proteínas extracelulares (colágeno I, III, IV, V y VI) (Figura 3). La distrofina es esencial para la transmisión lateral de la fuerza (Ramaswamy et al., 2011, Hughes et al 2015), mientras que la titina y la nebulina son más importantes para transmitir la fuerza longitudinalmente y la rigidez del sarcómero (Ottenheijm et al., 2012; Herzog et al., 2016; Powers et al., 2016). El papel esencial de las proteínas ECM en la RFD fue claramente demostrado por Mebes y col. (2008) en mujeres con síndrome de Ehlers-Danlos (híper movilidad articular). En este trabajo, las mujeres con articulaciones híper móviles (híper laxas) presentaron una RFD 15% más lenta pero sin diferencias en la fuerza máxima, lo que demuestra el papel esencial del tejido conectivo en la RFD. Hay pocos datos sobre las adaptaciones de estas proteínas del citoesqueleto al entrenamiento de la fuerza, y algunos estudios no observaron cambios (McGuigan et al., 2003, Woolstenhulme et al., 2006) mientras que otros estudios observaron mejoras (Lehti et al., 2007; Kosek and Bamman 2008, Parcell et al. 2009, Macaluso et al. 2014). Curiosamente, existe evidencia transversal para diferentes niveles de proteínas de transferencia de fuerza entre atletas entrenados y no entrenados (McBride et al., 2003). Sin embargo, se necesitan más estudios para analizar la influencia del entrenamiento de la fuerza sobre la red de proteínas del citoesqueleto y sobre la transmisión de la fuerza. Esto es especialmente cierto ya que estos grupos de proteínas tendrían un papel clave en la protección contra la lesión muscular inducida por la contracción y posiblemente también participarían en la transducción mecánica (Lovering y De Deyne 2004, Boppart et al., 2006, Palmisano et al., 2015, Hughes et al 2016).
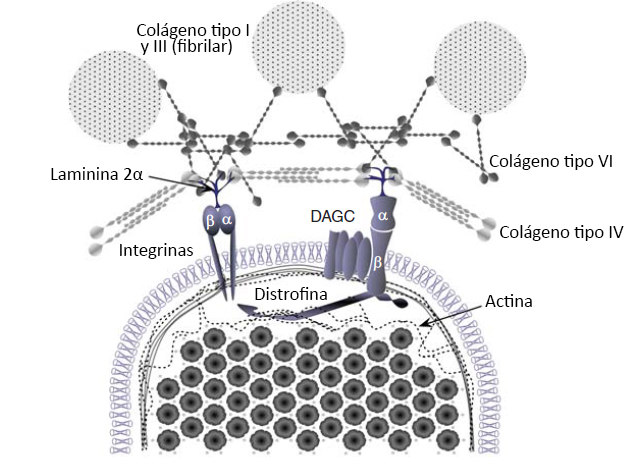
Figura 3. Interacción de la matriz extracelular (ECM), el tejido conectivo y las redes de proteínas del citoesqueleto que rodean a las miofibrillas del músculo esquelético. Las investigaciones sobre las adaptaciones celulares que se producen con el entrenamiento de fuerza se han centrado predominantemente dentro del músculo esquelético. Investigaciones recientes han comenzado a destacar el papel del complejo de glicoproteínas asociado a la distrofina (DAGC) y los complejos de integrina en la transmisión de fuerza, y la posible participación de las estructuras que se encuentran fuera del músculo en la transferencia de la fuerza y en la fuerza total. Pocos estudios han investigado la participación de la ECM en la transferencia de fuerza muscular y/o en la manera en que estos complejos pueden adaptarse durante un período de tiempo con el entrenamiento. Sin embargo, los individuos hiperlaxos (con mutaciones en el colágeno VI) tienen velocidades de desarrollo de la fuerza más lentas, lo que indica que la ECM es importante en la función muscular.
Al igual que con el entrenamiento de la resistencia, habría surgido un cambio en el paradigma de hipertrofia muscular existente porque la evidencia reciente sugiere que la carga no determina el aumento en el área transversal (CSA) que se produce con el entrenamiento de la fuerza. En estos estudios, levantar poca carga hasta la falla positiva produce una hipertrofia igual a la que se produce cuando se utiliza una carga elevada y menos repeticiones para llegar a la falla (Mitchell et al. 2012; Ogasawara et al. 2013; Schoenfeld et al. 2015; Morton et al. 2016). En el nuevo paradigma, la falla muscular momentánea es importante para la hipertrofia. La hipótesis de la importancia de la falla se centra en el reclutamiento de fibras musculares; en la falla, todas las unidadesmotoras son reclutadas independientemente de la carga (Counts et al., 2016). En una interesante investigación reciente, Counts y colegas (2016) utilizaron una intervención “sin carga” en la que los individuos debían contraer de manera repetida un músculo tan duro como pudieran a través de una gama completa de movimiento. Los investigadores observaron aumentos similares en el grosor muscular en los grupos “sin carga” y de alta carga. Sin embargo, a pesar de que el aumento en CSA con entrenamiento sin carga, con baja, alta carga fue equivalente, se necesitaron cargas elevadas para maximizar las ganancias de fuerza (Schoenfeld et al., 2015). El efecto del entrenamiento con carga baja sobre la masa muscular no debería sorprendernos dada la capacidad del ciclismo para aumentar la masa muscular (ver arriba); sin embargo, las vías moleculares que convierten cualquier carga en una señal bioquímica que da como resultado hipertrofia muscular siguen siendo poco claras. Estudios agudos han sugerido que hay un aumento dependiente de la carga en la actividad de mTORC1 después del entrenamiento de fuerza que se correlaciona con el aumento resultante en la masa muscular después del entrenamiento (Baar y Esser 1999). El aumento de la actividad de mTORC1 es el resultado de la señalización a través de una quinasa RxRxxS/T independiente de PI3K/Akt (Jacobs et al., 2013a). Sin embargo, aún no se ha demostrado si el incremento en la actividad de mTORC1 después de ejercicios de fuerza agudos favorece la hipertrofia muscular o simplemente refleja la cantidad de lesión y la respuesta inflamatoria subsiguiente, y cómo se altera la respuesta de mTORC1 al hacer el ejercicio hasta la falla. De manera similar, es necesario realizar mas investigaciones sobre el papel de los mecanismos independientes de mTORC1, como la señalización de miostatina y la biogénesis de ribosomas, antes de que podamos comprender con detalle su participación en la hipertrofia muscular inducida por el entrenamiento.
Entrenamiento Concurrente
La participación simultánea tanto en programas de entrenamiento de la resistencia como en programas de entrenamiento de la fuerza, produce un aumento similar en VO2max, pero menores adaptaciones en la fuerza en comparación con el entrenamiento de la fuerza solo (Hickson 1980). Existe alguna evidencia de que el entrenamiento concurrente no permite el desarrollo de hipertrofia muscular (Kraemer et al., 1995); sin embargo, cuando la frecuencia o la intensidad del entrenamiento concurrente disminuyen por debajo de 4 días a la semana y 70% de VO2max, el crecimiento muscular se produciría normalmente. Esto sugiere que algo vinculado al volumen y/o la intensidad del entrenamiento regula el efecto de entrenamiento concurrente. Una sugerencia es que mayor volumen e intensidad de entrenamiento producen un déficit calórico significativamente mayor y que esto disminuye la respuesta de síntesis de proteínas en respuesta a la alimentación (Areta et al., 2014). Al examinar el costo calórico del entrenamiento del estudio de Hickson (Figura 4) se observa que en la semana 5 del estudio, el grupo que realizó entrenamiento concurrente estaba gastando aprox. 6000 kcal por semana comparado con aprox. 2000 kcal por semana en el grupo que realizó entrenamiento de fuerza solo y esta diferencia siguió incrementándose durante las ultimas 5 semanas del estudio. La diferencia resultante de 4000 kcal por semana en el gasto de energía podría fácilmente sostener la diferencia en el tamaño y la fuerza musculares. Otra posible explicación para menor adaptación de fuerza es que el entrenamiento de resistencia disminuye el impulso nervioso asociado con el entrenamiento de fuerza. McCarthy y colegas (2002) se posicionaron en contra de esta hipótesis porque demostraron que no había diferencia en la amplitud EMG en varones que realizaron 10 semanas de entrenamiento concurrente en comparación con aquellos que realizaron solo entrenamiento de la fuerza. Sin embargo, es importante señalar que estos investigadores no pudieron observar un efecto del entrenamiento concurrente en la adaptación de la fuerza, lo que indicaría que la intensidad o el volumen del entrenamiento no fueron suficientes para poder observar un efecto del entrenamiento concurrente. Al igual que con otras modalidades de entrenamiento, aún no se ha descripto el efecto del entrenamiento concurrente sobre la transferencia de fuerza. Grosset y colegas (2009) han sugerido que el entrenamiento de la resistencia disminuye la transferencia de fuerza; sin embargo, aún no se ha determinado si esto podría contribuir con el efecto de entrenamiento concurrente.
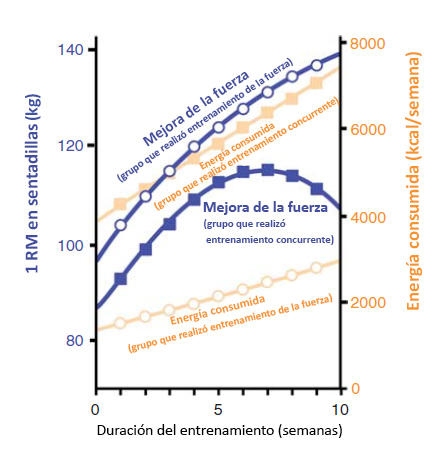
Figura 4. Impacto del entrenamiento de fuerza y del entrenamiento concurrente en el consumo de energía. El estudio clásico de Hickson (1980) fue el primero en observar una disminución en la mejora de la fuerza y en rendimiento de fuerza (1RM [1 repetición máxima]) en el tiempo con el entrenamiento concurrente (cuadrados azules sólidos). El descenso en las adaptaciones de la fuerza se observó una vez que el grupo concurrente estaba consumiendo el doble de kcal/semana que el grupo que realizó entrenamiento de fuerza solamente (círculos abiertos). Esto sugiere que el deterioro en las adaptaciones de fuerza con ejercicio simultáneo podría reflejar el papel del balance energético negativo en la hipertrofia muscular.
En cuanto a los mecanismos moleculares, el foco principal de la investigación ha sido la interacción entre la proteína quinasa activada por AMP (AMPK), que es activada por el entrenamiento de resistencia de alta intensidad y mTORC1, que es activado por el entrenamiento de la fuerza. Este enfoque es el resultado de trabajos realizados in vitro sobre división de células que han demostrado que AMPK puede inhibir directamente mTORC1 a través de tres mecanismos distintos (Inoki et al., 2002, Gwinn et al. 2008; Zhang et al., 2014). En concordancia con los datos obtenidos en cultivos celulares, estudios realizados en modelos con roedores donde los animales son tratados con AICAR, un fármaco activador de AMPK, la activación de mTORC1 disminuye claramente después del entrenamiento de la fuerza (Thomson et al., 1985). Por otra parte, en estudios realizados en humanos, la activación de AMPK producida por ejercicio de resistencia de alta intensidad tiene efectos mínimos sobre la activación de mTORC1 después de ejercicios de fuerza (Apro et al., 2015). La diferencia entre los datos obtenidos con roedores y los obtenidos con humanos podría reflejar el hecho de que el ejercicio activa preferentemente la isoforma α2 de AMPK (Lee-Young et al., 2008), mientras que AICAR activaría las isoformas α1 y α2. Curiosamente, la isoforma α1 de AMPK se activa para inhibir el crecimiento muscular inducido por la carga in vivo (McGee et al., 2008) y cuando esta proteína es bloqueada se produce una mayor hipertrofia muscular inducida por la carga (Mounier et al., 2009). Esto sugiere que la inhibición de mTORC1 por la activación de la AMPK producida por el ejercicio de resistencia, probablemente no sea el mecanismo molecular responsable de la menor hipertrofia y la menor fuerza que se observan con el entrenamiento concurrente.
Genética
Un aspecto importante de todas las adaptaciones al entrenamiento, ya sea de fuerza o de resistencia, es la genética (Bouchard et al., 2011). En la última década, la literatura ha comenzado a detallar el papel que desempeñan la heredabilidad y las diferencias genéticas (polimorfismos) en las adaptaciones a los entrenamientos (Beunen y Thomis, 2004; Huygens et al. 2004; Timons et al., 2010, Bouchard et al., 2011, Hughes et al., 2011). Numerosos estudios han puesto de manifiesto la diversidad de respuestas frente a los programas de entrenamiento de resistencia (Timmons et al., 2010) o de la fuerza (Petrella et al., 2008, Erskine et al., 2010) en humanos y en ratas (Koch et al., 2013), clasificando frecuentemente a los individuos como no respondedores o respondedores extremos en función de lo fenotipos musculares medidos (Petrella et al., 2008, Timmons et al., 2010, Davidsen et al., Thalacker-Mercer et al., Churchward Venne et al, 2015, Stec et al. Al 2016). Sin embargo, Churchward-Venne y colegas (2015) desafiaron la idea de los “no respondedores” al ejercicio de la fuerza. En un análisis retrospectivo de un programa de entrenamiento de la fuerza realizado por varones y mujeres de edad avanzada, estos investigadores informaron que, a pesar de que existía una gran heterogeneidad en las respuestas adaptativas, todos los individuos presentaron la capacidad de adaptarse con el entrenamiento de la fuerza. Recientemente se planteó un desafío similar para los ejercicios de resistencia, lo que sugiere que los no respondedores que realizaron ejercicios mas duros eran capaces de presentar alguna adaptación (Montero y Lundby 2017). Aunque la existencia de verdaderos no respondedores sigue siendo controvertida, el nivel de las adaptaciones de fuerza y resistencia que se producen con el entrenamiento varía ampliamente (Petrella et al., 2008, Thalacker-Mercer et al., 2013, Stec et al.2016) en base a los perfiles de ARN mensajero (ARNm) y de microARN, y a la capacidad de traducción (Timmons et al., 2010, Davidsen et al., Thalacker-Mercer et al. 2013; Stec et al. 2016). Además, el hecho de que las ratas y los ratones pueden ser criados con el fin de que presenten una mayor o menor capacidad de correr indica que claramente existen genes que están determinando nuestra respuesta al entrenamiento (Koch et al., 2013). Una vez que comprendamos mejor la variabilidad en las adaptaciones, tal vez podamos usar esta información para determinar el programa de entrenamiento óptimo para un individuo determinado. Sin embargo, estos avances dependerán en gran medida del uso de grandes cohortes a través de iniciativas colaborativas tales como elMolecular Transducers of Physical Activity in Humans National Institutes of Health consortium (commonfund.nih.gov/ MolecularTransducers).
Conclusiones
Durante miles de años se ha observado el efecto del entrenamiento físico en el fenotipo muscular. En general, las personas que se han entrenado realizando ejercicios durante mucho tiempo desarrollarán una mejor entrega de oxígeno para la capacidad muscular y de resistencia, mientras que aquellos que realizan entrenamientos con cargas pesadas tendrán músculos más grandes y más fuertes. Sin embargo, los trabajos recientes que utilizan entrenamiento intervalado de corta duración y de alta intensidad para aumentar la resistencia y entrenamiento de fuerza con carga baja hasta la falla para aumentar el tamaño y la fuerza muscular, han desafiado la visión clásica de la especificidad del entrenamiento. Para que realmente podamos entender y predecir la adaptación que se producirá por un determinado ejercicio, debemos tener una mayor comprensión de los mecanismos moleculares que intervienen en el cambio del fenotipo muscular provocado por el entrenamiento. En tal sentido, nuestro progreso ha sido lento debido al sesgo inherente hacia las moléculas de señalización que ya han sido identificadas. Para dar el siguiente paso, necesitamos evaluar los eventos moleculares que se inician después de diferentes tipos de ejercicio (después de la aclimatación) que producen adaptaciones musculares similares de una manera no sesgada. Cuando identifiquemos las posibles moléculas candidatas, entonces deberemos entender cómo estos eventos interactúan con nuestra respuesta a la alimentación porque, finalmente, se necesita una combinación entre ejercicio y nutrición para que se produzcan los cambios que observamos en el fenotipo de los músculos con el entrenamiento.
Para citar este artículo en su versión original
David C. Hughes, Stian Ellefsen and Keith Baar. (2017). Adaptations to Endurance and Strength Training. ColdSpring Harb. Perspect. Med.doi: 10.1101/cshperspect.a029769
Referencias
- Aagaard P., Andersen J.L. (2010). Effects of strength training on endurance capacity in top-level endurance athletes. Scand. J. Med. Sci. Sports 20: 39–47.
- Aagaard P., Simonsen E.B., Andersen J.L., Magnusson P., Dyhre-Poulsen P. (2002). Increased rate of force development and neural drive of human skeletal muscle following resistance training. J. Appl. Physiol. (1985) 93: 1318–1326.
- Aagaard P., Magnusson P.S., Larsson B., Kjær M., Krustrup P. (2007). Mechanical muscle function, morphology, and fiber type in lifelong trained elderly. Med. Sci. Sports Exerc. 39: 1989–1996.
- Aagaard P., Andersen J., Bennekou M., Larsson B., Olesen J., Crameri R., Magnusson S.P., Kjaer M. (2011). Effects of resistance training on endurance capacity and muscle fiber composition in young top-level cyclists. Scand. J. Med. Sci. Sports 21: e298–e307.
- Albracht K., Arampatzis A. (2013). Exercise-induced changes in triceps surae tendon stiffness and muscle strength af-fect running economy in humans. Eur. J. Appl. Physiol. 113: 1605–1615.
- Allison S.J., Bailey D.M., Folland J.P. (2008). Prolonged static stretching does not influence running economy despite changes in neuromuscular function. J. Sports Sci. 26: 1489–1495.
- Andersen L.L., Aagaard P. (2006). Influence of maximal muscle strength and intrinsic muscle contractile properties on contractile rate of force development. Eur. J. Appl. Physiol. 96: 46–52.
- Apro W., Moberg M., Hamilton D.L., Ekblom B., van Hall G., Holmberg H.C., Blomstrand E. (2015). Resistance exercise-induced S6K1 kinase activity is not inhibited in human skeletal muscle despite prior activation of AMPK by high-intensity interval cycling. Am. J. Physiol. Endocrinol. Metab. 308: E470–E481.
- Arampatzis A., De Monte G., Karamanidis K., Morey-Klapsing G., Stafilidis S., Bruggemann G.P. (2006). Influence of the muscle-tendon unit’s mechanical and morphological properties on running economy. J. Exp. Biol. 209: 3345– 3357.
- Areta J.L., Burke L.M., Camera D.M., West D.W., Crawshay S., Moore D.R., Stellingwerff T., Phillips S.M., Hawley J.A., Coffey V. G. (2014). Reduced resting skeletal muscle protein synthesis is rescued by resistance exercise and protein ingestion following short-term energy deficit. Am. J. Physiol. Endocrinol. Metab. 306: E989–E997.
- Baar K., Esser K. (1999). Phosphorylation of p70S6kcorrelates with increased skeletal muscle mass following resistance exercise. Am. J. Physiol. Cell. Physiol. 276: C120–C127.
- Baar K., Wende A.R., Jones T.E., Marison M., Nolte L.A., Chen M., Kelly D.P., Holloszy J.O. (2002). Adaptations of skeletal muscle to exercise: Rapid increase in the transcriptional coactivator PGC-1. FASEB J 16: 1879–1886.
- Baker S.J., Fearon E.R., Nigro J.M., Hamilton S.R., Preisinger A.C., Jessup J.M., van Tuinen P., Ledbetter D.H., Barker D.F., Nakamura Y., et al. (1989). Chromosome 17 deletions and p53 gene mutations in colorectal carcinomas. Science 244: 217–221.
- Barnes K.R., Kilding A.E. (2015). Strategies to improve running economy. Sports Med. 45: 37–56.
- Barnes K.R., Mcguigan M.R., Kilding A.E. (2014). Lower-body determinants of running economy in male and female distance runners. J. Strength Cond. Res. 28: 1289–1297.
- Bartlett J.D., Joo C.H., Jeong T.S., Louhelainen J., Cochran A.J., Gibala M.J., Gregson W., Close G.L., Drust B., Morton J.P. (2012). Matched work high-intensity interval and continuous running induce similar increases in PGC-1a mRNA, AMPK, p38, and p53 phosphorylation in human skeletal muscle. J. Appl. Physiol. (1985) 112: 1135–1143.
- Bartlett J.D., Louhelainen J., Iqbal Z., Cochran A.J., Gibala M.J., Gregson W., Close G.L., Drust B., Morton J.P. (2013). Reduced carbohydrate availability enhances exercise-induced p53 signaling in human skeletal muscle: Implications for mitochondrial biogenesis. Am. J. Physiol. Regul. Integr. Comp. Physiol. 304: R450–R458.
- Bartlett J.D., Close G.L., Drust B., Morton J.P. (2014). The emerging role of p53 in exercise metabolism. Sports Med. 44: 303–309.
- Beattie K., Kenny I.C., Lyons M., Carson B.P. (2014). The effect of strength training on performance in endurance athletes. Sports Med. 44: 845–865.
- Beunen G., Thomis M. (2004). Gene powered? Where to go from heritability (h2) in muscle strength and power? Exerc. Sport Sci. Rev. 32: 148–154.
- Bishop D.J., Granata C., Eynon N. (2014). Can we optimize the exercise training prescription to maximize improvements in mitochondria function and content? Biochim. Biophys. Acta 1840: 1266–1275.
- Boppart M.D., Burkin D.J., Kaufman S.J. (2006). a7b1-integrin regulates mechano transduction and prevents skeletal muscle injury. Am. J. Physiol. Cell. Physiol. 290: C1660– C1665.
- Bouchard C., Rankinen T., Timmons J.A. (2011). Genomics and genetics in the biology of adaptation to exercise. Compr. Physiol. 1: 1603–1648.
- Brook M.S., Wilkinson D.J., Mitchell W.K., Lund J.N., Szewczyk N.J., Greenhaff P.L., Smith K., Atherton P.J. (2015). Skeletal muscle hypertrophy adaptations predominate in the early stages of resistance exercise training, matching deuterium oxide-derived measures of muscle protein synthesis and mechanistic target of rapamycin complex 1 signaling. FASEB J 29: 4485–4496.
- Brooks G.A. (2012). Bioenergetics of exercising humans. Compr. Physiol. 2: 537–562.
- Carroll T.J., Herbert R.D., Munn J., Lee M., Gandevia S.C. (2006). Contralateral effects of unilateral strength training: Evidence and possible mechanisms. J. Appl. Physiol. (1985) 101: 1514–1522.
- Cartee G.D., Hepple R.T., Bamman M.M., Zierath J.R. (2016). Exercise promotes healthy aging of skeletal muscle. Cell. Metab. 23: 1034–1047.
- Chapman A.R., Vicenzino B., Blanch P., Hodges P.W. (2008). Patterns of leg muscle recruitment vary between novice and highly trained cyclists. J. Electromyogr. Kinesiol. 18: 359–371.
- Churchward-Venne T.A., Tieland M., Verdijk L.B., Leenders M., Dirks M.L., de Groot L.C., van Loon LJ. 2015. There are no non responders to resistance-type exercise training in older men and women. J. Am. Med. Dir. Assoc. 16: 400–411.
- Cochran A.J., Percival M.E., Tricarico S., Little J.P., Cermak N., Gillen J.B., Tarnopolsky M.A., Gibala M.J. (2014). Intermittent and continuous high-intensity exercise training induce similar acute but different chronic muscle adaptations. Exp. Physiol. 99: 782–791.
- Counts B.R., Buckner S.L., Dankel S.J., Jessee M.B., Mattocks K.T., Mouser J.G., Laurentino G.C., Loenneke J.P. (2016). The acute and chronic effects of “NO LOAD” resistance training. . Behav. 164: 345–352.
- Coyle E.F. (1995). Integration of the physiological factors determining endurance performance ability. Exerc. Sport Sci. Rev. 23: 25–64.
- Coyle E., Hagberg J., Hurley B., Martin W., Ehsani A., Holloszy J. (1983). Carbohydrate feeding during prolonged strenu-ous exercise can delay fatigue. J. Appl. Physiol. (1985) 55: 230–235.
- Coyle E.F., Coggan A.R., Hemmert M., Ivy J.L. (1986). Muscle glycogen utilization during prolonged strenuous exercise when fed carbohydrate. J. Appl. Physiol. (1985) 61: 165– 172.
- Coyle E.F., Coggan AR, Hopper M, Walters TJ. (1988). Determinants of endurance in well trained cyclists. .J. Appl. Physiol. (1985) 64: 2622–2630.
- Craib M.W., Mitchell V.A., Fields K.B., Cooper T.R., Hopewell R., Morgan D.W. (1996). The association between flexibility and running economy in sub-elite male distance runners. Med. Sci. Sports Exerc. 28: 737–743.
- Cui G., Park S., Badeaux A.I., Kim D., Lee J., Thompson J.R., Yan F., Kaneko S., Yuan Z., Botuyan M.V. (2012). PHF20 is an effector protein of p53 double lysine methylation that stabilizes and activates p53. Nat. Struct. Mol. Biol. 19: 916–924.
- Cureton K.J., Collins M.A., Hill D.W., McElhannon F.M.Jr. (1988). Muscle hypertrophy in men and women. Med. Sci. Sports Exerc. 20: 338–344.
- Damas F., Phillips S.M., Lixandrao M.E., Vechin F.C., Libardi C.A., Roschel H., Tricoli V., Ugrinowitsch C. (2016). Early resistance training-induced increases in muscle cross-sectional area are concomitant with edema-induced muscle swelling. Eur. J. Appl. Physiol. 116: 49–56.
- Daussin F.N., Zoll J., Ponsot E., Dufour S.P., Doutreleau S., Lonsdorfer E., Ventura-Clapier R., Mettauer B, Piquard F., Geny B. (2008). Training at high exercise intensity promotes qualitative adaptations of mitochondrial function in human skeletal muscle. J. Appl. Physiol. (1985) 104: 1436–1441.
- Davidsen P.K., Gallagher I.J., Hartman J.W., Tarnopolsky M.A., Dela F., Helge J.W., Timmons J.A., Phillips S.M. (2011). High responders to resistance exercise training demonstrate differential regulation of skeletal muscle microRNA expression. J. Appl. Physiol. (1985) 110: 309–317.
- DeFreitas J.M., Beck T.W., Stock M.S., Dillon M.A., Kasishke P.R II. (2011). An examination of the time course of training-induced skeletal muscle hypertrophy. Eur. J. Appl. Physiol. 111: 2785–2790.
- Di Donato D.M., West D.W., Churchward-Venne T.A., Breen L., Baker S.K., Phillips S.M. (2014). Influence of aerobic exercise intensity on myofibrillar and mitochondrial protein synthesis in young men during early and late post exercise recovery. Am. J. Physiol. Endocrinol. Metab. 306: E1025– E1032.
- Durham W.J., Casperson S.L., Dillon E.L., Keske M.A., Paddon-Jones D., Sanford A.P., Hickner R.C., Grady J.J., Sheffield-Moore M. (2010). Age-related anabolic resistance after en-durance-type exercise in healthy humans. FASEB J 24: 4117–4127.
- Edgett B.A., Fortner M.L., Bonen A., Gurd B.J. 2013. Mammalian target of rapamycin pathway is up-regulated by both acute endurance exercise and chronic muscle contraction in rat skeletal muscle. Appl. Physiol. Nutr. Metab. 38: 862– 869.
- Egan B., Zierath J.R. (2013). Exercise metabolism and the molecular regulation of skeletal muscle adaptation. Cell Metab. 17: 162–184.
- Enoka R.M. 1988. Muscle strength and its development. Sports Med. 6: 146–168.
- Erskine R.M., Jones D.A., Williams A.G., Stewart C.E., Degens H. (2010). Inter-individual variability in the adaptation of human muscle specific tension to progressive resistance training. Eur. J. Appl. Physiol. 110: 1117–1125.
- Favier R., Constable S., Chen M., Holloszy J. (1986). Endurance exercise training reduces lactate production. J. Appl. Physiol. (1985) 61: 885–889.
- Fletcher J.R., Esau S.P., MacIntosh B.R. (2010). Changes in ten-don stiffness and running economy in highly trained distance runners. Eur. J. Appl. Physiol 110: 1037–1046.
- Folland J.P., Williams A.G. (2007). Morphological and neurological contributions to increased strength. Sports Med 37: 145–168.
- Frontera W.R., Meredith C.N., O’Reilly K.P., Knuttgen H.G., Evans W.J. (1988). Strength conditioning in older men: Skeletal muscle hypertrophy and improved function. J. Appl. Physiol. (1985) 64: 1038–1044.
- Fry A.C. (2004). The role of resistance exercise intensity on muscle fiber adaptations. Sports Med. 34: 663–679.
- Gibala M.J., McGee S.L. (2008). Metabolic adaptations to short-term high-intensity interval training: A little pain for a lot of gain? Exerc. Sport Sci. Rev. 36: 58–63.
- Gibala M.J., Little J.P., Van Essen M., Wilkin G.P., Burgomaster K.A., Safdar A., Raha S., Tarnopolsky M.A. (2006). Short-term sprint interval versus traditional endurance training: Similar initial adaptations in human skeletal muscle and exercise performance. J. Physiol. 575: 901–911.
- Gibala M.J., McGee S.L., Garnham A.P., Howlett K.F., Snow R.J., Hargreaves M. (2009). Brief intense interval exercise activates AMPK and p38 MAPK signaling and increases the expression of PGC-1a in human skeletal muscle. J. Appl. Physiol. (1985) 106: 929–934.
- Gibala M.J., Gillen J.B., Percival M.E. (2014). Physiological and health-related adaptations to low-volume interval training: Influences of nutrition and sex. Sports Med. 44: S127–S137.
- Gillen J.B., Gibala M.J. (2013). Is high-intensity interval train-ing a time-efficient exercise strategy to improve health and fitness? Appl. Physiol. Nutr. Metab. 39: 409–412.
- Goodpaster B.H., Park S.W., Harris T.B., Kritchevsky S.B., Nevitt M., Schwartz A.V., Simonsick E.M., Tylavsky F.A., Visser M., Newman A.B. (2006). The loss of skeletal muscle strength, mass, and quality in older adults: The health, aging andbody composition study. J. Gerontol. A. Biol. Sci .Med. Sci. 61: 1059–1064.
- Granata C., Oliveira R.S., Little J.P., Renner K., Bishop D.J. (2016a). Mitochondrial adaptations to high-volume exercise training are rapidly reversed after a reduction in training volume in human skeletal muscle. FASEB J 30: 3413–3423.
- Granata C., Oliveira R.S., Little J.P., Renner K., Bishop D.J. (2016b). Training intensity modulates changes in PGC-1a and p53 protein content and mitochondrial respiration, but not markers of mitochondrial content in human skeletal muscle. FASEB J 30: 959–970.
- Grosset J.F., Piscione J., Lambertz D., Perot C. (2009). Paired changes in electromechanical delay and musculo-tendinous stiffness after endurance or plyometric training. Eur. J. Appl. Physiol. 105: 131–139.
- Gwinn D.M., Shackelford D.B., Egan D.F., Mihaylova M.M., Mery A., Vasquez D.S., Turk B.E., Shaw R.J. (2008). AMPK phosphorylation of raptor mediates a metabolic check-point. Mol. Cell 30: 214–226.
- Häkkinen K., Pakarinen A. (1993). Acute hormonal responses to two different fatiguing heavy-resistance protocols in male athletes. J. Appl. Physiol. (1985) 74: 882–887.
- Häkkinen K., Kallinen M., Izquierdo M., Jokelainen K., Lassila H., Mälkiä E., Kraemer W., Newton R., Alen M. (1998ª). Changes in agonist-antagonist EMG, muscle CSA, and force during strength training in middle-aged and older people. J. Appl. Physiol. (1985) 84: 1341–1349.
- Häkkinen K., Newton R.U., Gordon S.E., McCormick M., Volek J.S., Nindl B.C., Gotshalk L.A., Campbell W.W., Evans W.J., Häkkinen A. (1998b). Changes in muscle morphology, electromyographic activity, and force production characteristics during progressive strength training in young and older men. J. Gerontol. A. Biol. Sci. Med. Sci. 53: B415– B423.
- Harber M.P., Crane J.D., Dickinson J.M., Jemiolo B., Raue U., Trappe T.A., Trappe S.W. (2009a) . Protein synthesis and the expression of growth-related genes are altered by running in human vastus lateralis and soleus muscles. Am. J. Physiol. Regul. Integr. Comp. Physiol. 296: R708–R714.
- Harber M.P., Konopka A.R., Douglass M.D., Minchev K., Kaminsky L.A., Trappe T.A., Trappe S. (2009b). Aerobic exercise training improves whole muscle and single myofiber size and function in older women. Am. J. Physiol. Regul. Integr. Comp. Physiol. 297: R1452–R1459.
- Harber M.P., Konopka A.R., Jemiolo B., Trappe S.W., Trappe T.A., Reidy P.T. (2010). Muscle protein synthesis and gene expression during recovery from aerobic exercise in the fasted and fed states. Am. J. Physiol. Regul. Integr. Comp. Physiol. 299: R1254–R1262.
- Harber M.P., Konopka A.R., Undem M.K., Hinkley J.M., Minchev K. ,Kaminsky L.A., Trappe T.A., Trappe S. (2012). Aerobic exercise training induces skeletal muscle hypertrophy and age-dependent adaptations in myofiber function in young and older men. J. Appl. Physiol. (1985) 113: 1495– 1504.
- Heise G., Shinohara M.,Binks L. (2008). Biarticular leg muscles and links to running economy. Int. J. Sports Med. 29: 688– 691.
- Herzog W., Schappacher G., DuVall M., Leonard T.R., Herzog J.A. (2016). Residual force enhancement following eccentriccontractions: A new mechanism involving titin. Physiology 31: 300–312.
- Hickson R.C. (1980). Interference of strength development by simultaneously training for strength and endurance. Eur. J. Appl. Physiol. Occup. Physiol. 45: 255–263.
- Holloszy J.O. (1967). Biochemical adaptations in muscle effects of exercise on mitochondrial oxygen uptake and respiratory enzyme activity in skeletal muscle. J. Biol. Chem. 242: 2278–2282.
- Holloszy J.O., Coyle E.F. (1984). Adaptations of skeletal muscle to endurance exercise and their metabolic consequences. J. Appl. Physiol. (1985) 56: 831–838.
- Houston M., Froese E., Valeriote S.P., Green H.J., Ranney D.A. (1983). Muscle performance, morphology and metabolic capacity during strength training and detraining: A one leg model. Eur. J. Appl. Physiol. Occup. Physiol. 51: 25–35.
- Hughes D.C., Day S.H., Ahmetov I.I., Williams A.G. (2011). Genetics of muscle strength and power: Polygenic profile similarity limits skeletal muscle performance. J. Sports Sci. 29: 1425–1434.
- Hughes D.C., Wallace M.A., Baar K. (2015). Effects of aging, exercise, and disease on force transfer in skeletal muscle. Am. J. Physiol. Endocrinol. Metab. 309: E1–E10.
- Hughes D.C., Marcotte G.R., Marshall A.G., West D.W., Baehr L.M., Wallace M.A., Saleh P.M., Bodine S.C., Baar K. (2016). Age-related differences in dystrophin: Impact on force transfer proteins, membrane integrity, and neuromuscular junction stability. J. Gerontol. A. Biol. Sci. Med. Sci. doi: 10.1093/gerona/glw109.
- Huygens W., Thomis M.A., Peeters M.W., Vlietinck R.F., Beunen G.P. (2004). Determinants and upper-limit heritabilities of skeletal muscle mass and strength. Can. J. Appl. Physiol. 29: 186–200.
- Inoki K., Li Y., Zhu T., Wu J., Guan K.L. (2002). TSC2 is phosphorylated and inhibited by Akt and suppresses mTOR signalling. Nat. Cell. Biol. 4: 648–657.
- Jacobs B.L., You J.S., Frey J.W., Goodman C.A., Gundermann D.M., Hornberger T.A. (2013a). Eccentric contractions in-crease the phosphorylation of tuberous sclerosis com-plex-2 (TSC2) and alter the targeting of TSC2 and the mechanistic target of rapamycin to the lysosome. J. Physiol. 591: 4611–4620.
- Jacobs R.A., Flück D., Bonne T.C., Bürgi S., Christensen P.M., Toigo M., Lundby C. (2013b). Improvements in exercise performance with high-intensity interval training coincide with an increase in skeletal muscle mitochondrial content and function. J. Appl. Physiol. (1985) 115: 785– 793.
- Jones D., Rutherford O., Parker D. (1989). Physiological changes in skeletal muscle as a result of strength training. Q. J. Exp. Physiol. 74: 233–256.
- Jones T.W., Howatson G., Russell M., French D.N. (2013). Performance and neuromuscular adaptations following differing ratios of concurrent strength and endurance training. J. Strength. Cond. Res. 27: 3342–3351.
- Joyner M.J., Coyle E.F. (2008). Endurance exercise performance: The physiology of champions. J. Physiol. 586: 35–44.
- Kidgell D.J., Frazer A.K., Rantalainen T., Ruotsalainen I., Ahtiainen J., Avela J., Howatson G. (2015). Increased cross-education of muscle strength and reduced corticospinalinhibition following eccentric strength training. Neuroscience 300: 566–575.
- Knuttgen H.G., Kraemer W.J. (1987). Terminology and measurement in exercise performance. J. Strength Cond. Res. 1: 1–10.
- Koch L.G., Pollott G.E., Britton S.L. (2013). Selectively bred rat model system for low and high response to exercise training. Physiol. Genomics 45: 606–614.
- Konopka A.R., Harber M.P. (2014). Skeletal muscle hypertrophy after aerobic exercise training. Exerc. Sport Sci. Rev. 42: 53–61.
- Konopka A.R., Douglass M.D., Kaminsky L.A., Jemiolo B., Trappe T.A., Trappe S., Harber M.P. (2010). Molecular adaptations to aerobic exercise training in skeletal muscle of older women. J. Gerontol. A. Biol. Sci. Med. Sci. 65: 1201– 1207.
- Korhonen M.T., Cristea A., Alen M., Häkkinen K., Sipilä S., Mero A., Viitasalo J.T., Larsson L., Suominen H. (2006). Aging, muscle fiber type, and contractile function in sprint-trained athletes. J. Appl. Physiol. (1985) 101: 906–917.
- Kosek D.J., Bamman M.M. (2008). Modulation of the dystrophin-associated protein complex in response to resistance training in young and older men. J. Appl. Physiol. (1985) 104: 1476–1484.
- Kraemer W.J., Gordon S., Fleck S., Marchitelli L., Mello R., Dziados J., Friedl K., Harman E., Maresh C., Fry A. (1991). Endogenous anabolic hormonal and growth factor responses to heavy resistance exercise in males and females. Int. J. Sports Med. 12: 228–235.
- Kraemer W.J., Patton J.F., Gordon S.E., Harman E.A., Deschenes M.R., Reynolds K., Newton R.U., Triplett N.T., Dziados J.E. (1995). Compatibility of high-intensity strength and en-durance training on hormonal and skeletal muscle adaptations. J. Appl. Physiol. (1985) 78: 976–989.
- Latella C., Kidgell D.J., Pearce A.J. (2012). Reduction in corticospinal inhibition in the trained and untrained limb following unilateral leg strength training. Eur. J. Appl. Physiol. 112: 3097–3107.
- Laursen P.B., Jenkins D.G. (2002). The scientific basis for high-intensity interval training. Sports Med. 32: 53–73.
- Lee-Young R.S., Koufogiannis G., Canny B.J., McConell G.K. (2008). Acute exercise does not cause sustained elevations in AMPK signaling or expression. Med. Sci. Sports Exerc. 40: 1490–1494.
- Lehti T.M., Kalliokoski R., Komulainen J. (2007). Repeated bout effect on the cytoskeletal proteins titin, desmin, and dystrophin in rat skeletal muscle. J. Muscle Res. Cell. Motil. 28: 39–47.
- Levine A., Hu W., Feng Z. (2006). The P53 pathway: What questions remain to be explored? Cell Death Differ. 13: 1027–1036.
- Little J.P., Safdar A., Cermak N., Tarnopolsky M.A., Gibala M.J. (2010a). Acute endurance exercise increases the nuclear abundance of PGC-1a in trained human skeletal muscle. Am. J. Physiol. Regul. Integr. Comp. Physiol. 298: R912–R917.
- Little J.P., Safdar A., Wilkin G.P., Tarnopolsky M.A., Gibala M.J. (2010b). A practical model of low-volume high-intensity interval training induces mitochondrial biogenesis inhuman skeletal muscle: Potential mechanisms. J. Physiol 588: 1011–1022.
- Little J.P., Safdar A., Bishop D., Tarnopolsky M.A., Gibala M.J. (2011). An acute bout of high-intensity interval training increases the nuclear abundance of PGC-1a and activates mitochondrial biogenesis in human skeletal muscle. Am. J. Physiol. Regul. Integr. Comp. Physiol. 300: R1303–R1310.
- Lovering R.M., De Deyne P.G. (2004). Contractile function, sarcolemma integrity, and the loss of dystrophin after skeletal muscle eccentric contraction-induced injury. Am. J. Physiol. Cell Physiol. 286: C230–C238.
- Macaluso F., Isaacs A.W., Di Felice V., Myburgh K.H. (2014). Acute change of titin at mid-sarcomere remains despite 8 wk of plyometric training. J. Appl. Physiol. (1985) 116: 1512–1519.
- MacInnis M.J., Zacharewicz E., Martin B.J., Haikalis M.E., Skelly L.E., Tarnopolsky M.A., Murphy R.M., Gibala M.J. (2016). Superior mitochondrial adaptations in human skeletal muscle after interval compared to continuous single-leg cycling matched for total work. J. Physiol. doi: 10.1113/ JP272570.
- Maffiuletti N.A., Aagaard P., Blazevich A.J., Folland J., Tillin N., Duchateau J. (2016). Rate of force development: Physiological and methodological considerations. Eur. J. Appl. Physiol. 116: 1091–1116.
- Mascher H., Ekblom B., Rooyackers O., Blomstrand E. (2011). Enhanced rates of muscle protein synthesis and elevated mTOR signalling following endurance exercise in human subjects. Acta Physiol. (Oxf ) 202: 175–184.
- Matoba S., Kang J.G., Patino W.D., Wragg A., Boehm M., Gavrilova O., Hurley P.J., Bunz F., Hwang P.M. (2006). p53 regulates mitochondrial respiration. Science 312: 1650–1653.
- McBride J.M., Triplett-McBride T., Davie A.J., Abernethy P.J., Newton R.U. (2003). Characteristics of titin in strength and power athletes. Eur. J. Appl. Physiol. 88: 553–557.
- McCall G.E., Byrnes W.C., Fleck S.J., Dickinson A., Kraemer W.J. (1999). Acute and chronic hormonal responses to resistance training designed to promote muscle hypertrophy. Can. J. Appl. Physiol. 24: 96–107.
- McCarthy J.P., Pozniak M.A., Agre J.C. (2002). Neuromuscular adaptations to concurrent strength and endurance training. Med. Sci. Sports Exerc. 34: 511–519.
- McGee S.L., Mustard K.J., Hardie D.G., Baar K. (2008). Normal hypertrophy accompanied by phosphoryation and acti-vation of AMP-activated protein kinase a1 following overload in LKB1 knockout mice. J. Physiol. 586: 1731– 1741.
- McGregor R.A., Cameron-Smith D., Poppitt S.D. (2014). It is not just muscle mass: A review of muscle quality, com-position and metabolism during ageing as determinants of muscle function and mobility in later life. Longev Healthspan 3: 9.
- McGuigan M.R., Sharman M.J., Newton R.U., Davie A.J., Murphy A.J., McBride J.M. (2003). Effect of explosive resistance training on titin and myosin heavy chain isoforms in trained subjects. J. Strength Cond. Res. 17: 645–651.
- Mebes C., Amstutz A., Luder G., Ziswiler H.R., Stettler M., Villiger P.M., Radlinger L. (2008). Isometric rate of force development, maximum voluntary contraction, and balance in women with and without joint hypermobility. Arthritis Rheum. 59: 1665–1669.
- Mero A., Hulmi J., Salmijärvi H., Katajavuori M., Haverinen M., Holviala J., Ridanpä T., Häkkinen K., Kovanen V., Ahtiainen J. (2013). Resistance training induced increase inmuscle fiber size in young and older men. Eur. J. Appl. Physiol. 113: 641–650.
- Mitchell C.J., Churchward-Venne T.A., West D.W., Burd N.A., Breen L., Baker S.K., Phillips S.M. (2012). Resistance exercise load does not determine training-mediated hypertrophic gains in young men. J. Appl. Physiol. (1985) 113: 71–77.
- Montero D., Lundby C. (2017). Refuting the myth of non-response to exercise training: “Non-responders” do respond to higher dose of training. J. Physiol. doi: 10.1113/ JP273480.
- Morton R.W., Oikawa S.Y., Wavell C.G., Mazara N., McGlory C., Quadrilatero J., Baechler B.L., Baker S.K., Phillips S.M. (2016). Neither load nor systemic hormones determine resistance training-mediated hypertrophy or strength gains in resistance-trained young men. J. Appl. Physiol. (1985) 121: 129–138.
- Mounier R., Lantier L., Leclerc J., Sotiropoulos A., Pende M., Daegelen D., Sakamoto K., Foretz M., Viollet B. (2009).Important role for AMPKa1 in limiting skeletal muscle cell hypertrophy. FASEB J. 23: 2264–2273.
- Munn J., Herbert R.D., Gandevia S.C. (2004). Contralateral effects of unilateral resistance training: A meta-analysis. J. Appl. Physiol. (1985) 96: 1861–1866.
- Munn J., Herbert R.D., Hancock M.J., Gandevia S.C. (2005). Training with unilateral resistance exercise increases contralateral strength. J. Appl. Physiol. (1985) 99: 1880–1884.
- Narici M.V., Roi G., Landoni L., Minetti A., Cerretelli P. (1989). Changes in force, cross-sectional area and neural activation during strength training and detraining of the human quadriceps. Eur. J. Appl. Physiol. Occup. Physiol. 59: 310–319.
- Nelson A., Kokkonen J., Eldredge C., Cornwell A., Glickman-Weiss E. (2001). Chronic stretching and running economy. Scand. J. Med. Sci. Sports 11: 260–265.
- Newman A.B., Kupelian V., Visser M., Simonsick E.M., Goodpaster B.H., Kritchevsky S.B., Tylavsky F.A., Rubin S.M., Harris T.B. (2006). Strength, but not muscle mass, is associated with mortality in the health, aging and body composition study cohort. J. Gerontol. A. Biol. Sci. Med. Sci. 61: 72–77.
- Nigro J.M., Baker S.J., Preisinger A.C., Jessup J.M., Hostetter R., Cleary K., Bigner S.H., Davidson N., Baylin S., Devilee P., et al. (1989). Mutations in the p53 gene occur in diverse human tumor types. Nature 342: 705–708.
- Ogasawara R., Loenneke J.P., Thiebaud R.S., Abe T. (2013). Low-load bench press training to fatigue results in muscle hypertrophy similar to high-load bench press training. Int. J. Clin. Med. 4: 114.
- Ottenheijm C.A., Granzier H., Labeit S. (2012). The sarcomeric protein nebulin: Another multifunctional giant in charge of muscle strength optimization. Front Physiol. 3: 37.
- Paavolainen L., Häkkinen K., Hämäläinen I., Nummela A., Rusko H. (1999ª). Explosive-strength training improves 5-km running time by improving running economy and muscle power. J. Appl. Physiol. (1985) 86: 1527–1533.
- Paavolainen L., Nummela A., Rusko H., Häkkinen K. (1999b). Neuromuscular characteristics and fatigue during 10 km running. Int. J. Sports Med. 20: 516–521.
- Paavolainen L.M., Nummela A., Rusko H.K. (1999c). Neuromuscular characteristics and muscle power as determinants of 5-km running performance. Med. Sci. Sports Exerc. 31: 124–130.
- Palmisano M.G., Bremner S.N., Hornberger T.A., Meyer G.A., Domenighetti A.A., Shah S.B., Kiss B., Kellermayer M., Ryan A.F., Lieber R.L. (2015). Skeletal muscle intermediate filaments form a stress-transmitting and stress-signaling network. J. Cell Sci. 128: 219–224.
- Parcell A.C., Woolstenhulme M.T., Sawyer R.D. (2009). Structural protein alterations to resistance and endurance cycling exercise training. J. Strength Cond. Res. 23: 359–365.
- Park J.Y., Wang Py., Matsumoto T., Sung H.J., Ma W., Choi J.W., Anderson S.A., Leary S.C., Balaban R.S., Kang J.G. (2009). p53 improves aerobic exercise capacity and augments skeletal muscle mitochondrial DNA content. Circ. Res. 105: 705– 712.
- Park S., Kim D., Dan H.C., Chen H., Testa J.R, Cheng J.Q. (2012). Identification of Akt interaction protein PHF20/TZP that transcriptionally regulates p53. J. Biol. Chem. 287: 11151–11163.
- Petrella J.K., Kim Js, Mayhew D.L., Cross J.M., Bamman M.M. (2008). Potent myofiber hypertrophy during resistance training in humans is associated with satellite cell mediated myonuclear addition: A cluster analysis. J. Appl. Physiol. (1985) 104: 1736–1742.
- Phillips B.E., Williams J.P., Gustafsson T., Bouchard C., Rankinen , Knudsen S., Smith K., Timmons J.A., Atherton P.J. (2013). Molecular networks of human muscle adaptation to exercise and age. PLoS Genet. 9: e1003389.
- Philp A., Schenk S., Perez-Schindler J., Hamilton D.L., Breen L., Laverone E., Jeromson S., Phillips S.M., Baar K. (2015). Rapamycin does not prevent increases in myofibrillar or mitochondrial protein synthesis following endurance exercise. J. Physiol. 593: 4275–4284.
- Pilegaard H., Saltin B., Neufer P.D. (2003). Exercise induces transient transcriptional activation of the PGC-1a gene in human skeletal muscle. J. Physiol. 546: 851–858.
- Powers K., Nishikawa K., Joumaa V., Herzog W. (2016). De-creased force enhancement in skeletal muscle sarcomeres with a deletion in titin. J. Exp. Biol. 219: 1311–1316.
- Pyka G., Lindenberger E., Charette S., Marcus R. (1994). Muscle strength and fiber adaptations to a year-long resistance training program in elderly men and women. J. Gerontol. 49: M22–M27.
- Ramaswamy K.S., Palmer M.L., van der Meulen J.H., Renoux A., Kostrominova T.Y., Michele D.E., Faulkner J.A. (2011). Lateral transmission of force is impaired in skeletal muscles of dystrophic mice and very old rats. J. Physiol. 589: 1195– 1208.
- Rønnestad B.R., Hansen E.A., Raastad T. (2010). In-season strength maintenance training increases well-trained cy-clists’ performance. Eur. J. Appl. Physiol. 110: 1269–1282.
- Rønnestad B.R., Hansen E.A., Raastad T. (2011). Strength training improves 5-min all-out performance following 185 min of cycling. Scand. J. Med. Sci. Sports 21: 250–259.
- Rønnestad B.R., Hansen E.A., Raastad T. (2012). High volume of endurance training impairs adaptations to 12 weeks of strength training in well-trained endurance athletes. Eur. J. Appl. Physiol. 112: 1457–1466.
- Sale DG. 1988. Neural adaptation to resistance training. Med. Sci. Sports Exerc. 20: S135–S145.
- Saleem A., Hood D.A. (2013). Acute exercise induces tumor suppressor protein p53 translocation to the mitochondria and promotes a p53–Tfam–mitochondrial DNA complex in skeletal muscle. J. Physiol. 591: 3625–3636.
- Saleem A., Adhihetty P.J., Hood D.A. (2009). Role of p53 in mitochondrial biogenesis and apoptosis in skeletal muscle. Physiol. Genomics 37: 58–66.
- Saunders P.U., Pyne D.B., Telford R.D., Hawley J.A. (2004). Factors affecting running economy in trained distance runners. Sports Med. 34: 465–485.
- Schoenfeld B.J., Peterson M.D., Ogborn D., Contreras B., Sonmez G.T. (2015). Effects of low-vs. high-load resistance training on muscle strength and hypertrophy in well-trained men. J. Strength Cond. Res. 29: 2954–2963.
- Schroeder E.T., Villanueva M., West D., Phillips S.M. (2013). Are acute post-resistance exercise increases in testosterone, growth hormone, and IGF-1 necessary to stimulate skeletal muscle anabolism and hypertrophy? Med. Sci. Sports Exerc. 45: 2044–2051.
- Scripture E., Smith T.L., Brown E.M. (1894). On the education of muscular control and power. Stud Yale Psychol. Lab. 2: 114–119.
- Serpiello F.R., McKenna M.J., Bishop D.J., Aughey R.J., Caldow M.K., Cameron-Smith D., Stepto N.K. (2012). Repeated sprints alter signaling related to mitochondrial biogenesis in humans. Med. Sci. Sports Exerc. 44: 827–834.
- Seynnes O.R., de Boer M., Narici M.V. (2007). Early skeletal muscle hypertrophy and architectural changes in re-sponse to high-intensity resistance training. J. Appl. Physiol. (1985) 102: 368–373.
- Short K.R., Vittone J.L., Bigelow M.L., Proctor D.N., Nair K.S. (2004). Age and aerobic exercise training effects on whole body and muscle protein metabolism. Am. J. Physiol. Endocrinol. Metab. 286: E92–E101.
- Shrier I. (2004). Does stretching improve performance?: A systematic and critical review of the literature. Clin. J. Sport Med. 14: 267–273.
- Sleivert G.G., Wenger H.A. (1994). Reliability of measuring iso-metric and isokinetic peak torque, rate of torque development, integrated electromyography, and tibial nerve conduction velocity. Arch. Phys. Med. Rehabil. 75: 1315– 1321.
- Staron R., Malicky E., Leonardi M., Falkel J., Hagerman F., Dudley G. (1990). Muscle hypertrophy and fast fiber type conversions in heavy resistance-trained women. Eur. J. Appl. Physiol. Occup. Physiol. 60: 71–79.
- Staron R.S., Leonardi M.J., Karapondo D.L., Malicky E.S., Falkel J.E., Hagerman F.C., Hikida R.S. (1991). Strength and skeletal muscle adaptations in heavy-resistance-trained women after detraining and retraining. J. Appl. Physiol. (1985) 70: 631–640.
- Staron R., Karapondo D., Kraemer W., Fry A., Gordon S., Falkel J., Hagerman F., Hikida R.. (1994). Skeletal muscle adaptations during early phase of heavy-resistance training in men and women. J. Appl. Physiol. (1985) 76: 1247–1255.
- Stec M.J., Kelly N.A., Many G.M., Windham S.T., Tuggle S.C., Bamman M.M. (2016). Ribosome biogenesis may augment resistance training-induced myofiber hypertrophy and is required for myotube growth in vitro. Am. J. Physiol. Endocrinol. Metab. 310: E652–E661.
- Storen O., Helgerud J., Stoa E.M., Hoff J. (2008). Maximal strength training improves running economy in distance runners. Med. Sci. Sports Exerc. 40: 1087.
- Suetta C., Aagaard P., Rosted A., Jakobsen A.K., Duus B., Kjaer M., Magnusson S.P. (2004). Training-induced changes in muscle CSA, muscle strength, EMG, and rate of force development inelderly subjects after long-term unilateral disuse. J. Appl. Physiol. (1985) 97: 1954–1961.
- Sunde A., Støren Ø., Bjerkaas M., Larsen M.H., Hoff J., Helgerud J. (2010). Maximal strength training improves cy-cling economy in competitive cyclists. J. Strength Cond. Res. 24: 2157–2165.
- Thalacker-Mercer A., Stec M., Cui X., Cross J., Windham S., Bamman M. (2013). Cluster analysis reveals differential transcript profiles associated with resistance training-induced human skeletal muscle hypertrophy. Physiol. Genomics 45: 499–507.
- Thomson D.M., Fick C.A., Gordon S.E. (1985).AMPK activation attenuates S6K1, 4E-BP1, and eEF2 signaling responses to high-frequency electrically stimulated skeletal muscle contractions. J. Appl. Physiol. (1985) 104: 625–632.
- Timmons J.A., Knudsen S., Rankinen T., Koch L.G., Sarzynski M., Jensen T., Keller P., Scheele C., Vollaard N.B., Nielsen S. (2010). Using molecular classification to predict gains in maximal aerobic capacity following endurance exercise training in humans. J. Appl. Physiol. (1985) 108: 1487– 1496.
- Trappe T.A., Carroll C.C., Dickinson J.M., LeMoine J.K., Haus J.M., Sullivan B.E., Lee J.D., Jemiolo B., Weinheimer E.M., Hollon C.J. (2011). Influence of acetaminophen and ibuprofen on skeletal muscle adaptations to resistance exercise in older adults. Am. J. Physiol. Regul. Integr. Comp. Physiol. 300: R655–R662.
- Trehearn T.L., Buresh R.J. (2009). Sit-and-reach flexibility and running economy of men and women collegiate distance runners. J. Strength Cond. Res. 23: 158–162.
- Vikmoen O., Ellefsen S., Trøen Ø., Hollan I., Hanestadhaugen M., Raastad T., Rønnestad B.R. (2015). Strength training improves cycling performance, fractional utilization of VO2maxand cycling economy in female cyclists. Scand. J. Med. Sci. Sports 26: 384–396.
- Visser M., Goodpaster B.H., Kritchevsky S.B., Newman A.B., Nevitt M., Rubin S.M., Simonsick E.M., Harris T.B. (2005). Muscle mass, muscle strength, and muscle fat infiltration as predictors of incident mobility limitations in well-functioning older persons. J. Gerontol. A. Biol. Sci. Med. Sci. 60: 324–333.
- Wernbom M., Augustsson J., Thomee R. (2007). The influence of frequency, intensity, volume and mode of strengthtraining on whole muscle cross-sectional area in humans. Sports Med. 37: 225–264.
- West D.W., Kujbida G.W., Moore D.R., Atherton P., Burd N.A., Padzik J.P., De Lisio M., Tang J.E., Parise G.., Rennie MJ. (2009). Resistance exercise-induced increases in putative anabolic hormones do not enhance muscle protein synthesis or intracellular signalling in young men. J. Appl. Physiol. (1985) 587: 5239–5247.
- West D.W., Burd N.A., Tang J.E., Moore D.R., Staples A.W., Holwerda A.M., Baker S.K., Phillips S.M. (2010). Elevations in ostensibly anabolic hormones with resistance exercise enhance neither training-induced muscle hypertrophy nor strength of the elbow flexors. J. Appl. Physiol. (1985) 108: 60–67.
- West D.W., Burd N.A., Churchward-Venne T.A., Camera D.M., Mitchell C.J., Baker S.K., Hawley J.A., Coffey V.G., Phillips S.M. (2012). Sex-based comparisons of myofibrillar protein synthesis after resistance exercise in the fed state. J. Appl. Physiol. (1985) 112: 1805–1813.
- West D.W.D., Lee-Barthel A., McIntyre T., Shamim B., Lee C.A., Baar K. (2015). The exercise-induced biochemical milieu enhances collagen content and tensile strength of engineered ligaments. J. Appl. Physiol. (1985) 593: 4665–4675.
- Woolstenhulme M.T., Conlee R.K., Drummond M.J., Stites A.W., Parcell A.C. (2006). Temporal response of desmin and dys-trophin proteins to progressive resistance exercise in human skeletal muscle. J. Appl. Physiol. (1985) 100: 1876– 1882.
- Yamamoto L.M., Lopez R.M., Klau J.F., Casa D.J., Kraemer W.J., Maresh C.M. (2008). The effects of resistance training on endurance distance running performance among highly trained runners: A systematic review. J. Strength Cond. Res. 22: 2036–2044.
- Yasuda Y., Miyamura M. (1983). Cross transfer effects of muscular training on blood flow in the ipsilateral and contralateral forearms. Eur. J. Appl. Physiol. Occup. Physiol. 51: 321–329.
- Zampieri S., Pietrangelo L., Loefler S., Fruhmann H., Vogelauer M., Burggraf S., Pond A., Grim-Stieger M., Cvecka J,. Sedliak M. (2015). Lifelong physical exercise delays age-associated skeletal muscle decline. J. Gerontol. A. Biol. Sci. Med. Sci. 70: 163–173.
- Zhang C.S., Jiang B., Li M., Zhu M., Peng Y., Zhang Y.L., Wu Y.Q. Li T.Y., Liang Y., Lu Z., et al. (2014). The lysosomal v-ATPase-Ragulator complex is a common activator for AMPK and mTORC1, acting as a switch between catabolism and anabolism. Metab.. 20: 526–540.




